
题目列表(包括答案和解析)
(11分)据元素周期表及周期律的知识回答下列问题:
(1)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2 2NaH)。生成物氢化钠的电子式为__________,含有的化学键为_______键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为__________,含有的化学键为_______键(填“离子”、“共价”或“金属”)。
(2)元素周期表中元素的性质存在递变规律,下列比较正确的是____________。
a.离子半径:Na+>Mg2+>S2->Cl- b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
(3)共价键的极性随共用电子对偏移程度的增大而增强,SiH4、PH3、H2S、HCl共价键的极性由强到弱的顺序是_____________。
(4)元素Cl与S元素相比,非金属性较强的是_____________(用元素符号表示),下列表述中能证明这一事实的是________________
a.常温下S比Cl2单质的熔点高 b.Cl2与S的氢化物发生反应,产生S单质
c.S与Cl2形成的化合物中S元素呈正价态
d.比较两元素的单质与H2化合时得电子的数目
(5)HF比HCl沸点高,原因是___________________________________________。
(6)下表为部分非金属元素与氢形成共价键的键长与键能数据:
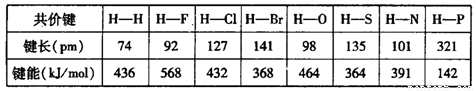
根据表中数据,归纳共价键键能与键长的关系______________________________。
(11分)据元素周期表及周期律的知识回答下列问题:
(1)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H22NaH)。生成物氢化钠的电子式为__________,含有的化学键为_______键(填“离子”、“共价”或“金属”)。
(2)元素周期表中元素的性质存在递变规律,下列比较正确的是____________。
a.离子半径:Na+>Mg2+>S2->Cl- b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
(3)共价键的极性随共用电子对偏移程度的增大而增强,SiH4、PH3、H2S、HCl共价键的极性由强到弱的顺序是_____________。
(4)元素Cl与S元素相比,非金属性较强的是_____________(用元素符号表示),下列表述中能证明这一事实的是________________
a.常温下S比Cl2单质的熔点高 b.Cl2与S的氢化物发生反应,产生S单质
c.S与Cl2形成的化合物中S元素呈正价态
d.比较两元素的单质与H2化合时得电子的数目
(5)HF比HCl沸点高,原因是___________________________________________。
(6)下表为部分非金属元素与氢形成共价键的键长与键能数据:
根据表中数据,归纳共价键键能与键长的关系______________________________。
(11分)据元素周期表及周期律的知识回答下列问题:
(1)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2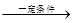 2NaH)。生成物氢化钠的电子式为__________,含有的化学键为_______键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为__________,含有的化学键为_______键(填“离子”、“共价”或“金属”)。
(2)元素周期表中元素的性质存在递变规律,下列比较正确的是____________。
a.离子半径:Na+>Mg2+>S2->Cl- b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
(3)共价键的极性随共用电子对偏移程度的增大而增强,SiH4、PH3、H2S、HCl共价键的极性由强到弱的顺序是_____________。
(4)元素Cl与S元素相比,非金属性较强的是_____________(用元素符号表示),下列表述中能证明这一事实的是________________
a.常温下S比Cl2单质的熔点高 b.Cl2与S的氢化物发生反应,产生S单质
c.S与Cl2形成的化合物中S元素呈正价态
d.比较两元素的单质与H2化合时得电子的数目
(5)HF比HCl沸点高,原因是___________________________________________。
(6)下表为部分非金属元素与氢形成共价键的键长与键能数据: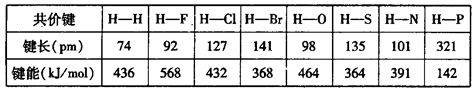
根据表中数据,归纳共价键键能与键长的关系______________________________。
 2NaH)。生成物氢化钠的电子式为__________,含有的化学键为_______键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为__________,含有的化学键为_______键(填“离子”、“共价”或“金属”)。
有关媒体报道天津巨能化学有限公司生产的巨能钙含有双氧水,经农业部产品质量监督检验测试中心检测,部分送检品种不同程度地含双氧水。双氧水属于危险化学品及有毒有害物质,以前也曾作为漂白剂、杀菌剂、防腐剂广泛用于食品中。下列有关H2O2的叙述中正确的是 ( )
A.H2O2是二元弱酸,将H2O2溶液滴入酚酞的NaOH溶液中,红色消失,一定是因为发生了酸碱中和反应
B.H2O2分子中只含有极性共价键
C.H2O2的自然分解过程非常缓慢一般不易察觉,但正因为如此一般药用的双氧水在贮存期间也会逐渐失效
D.人体中含有过氧化氢酶,过氧化氢酶可使H2O2分解,因此人体即使吸收多量的H2O2也没有关系,可以被过氧化氢酶分解为无毒物质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com