
题目列表(包括答案和解析)
A.相同
B.不同
C.仅K+浓度相同
D.其成分无法比较
K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体,且A是一种不含金属元素的盐,受热分解能得到三种物质的量相等的产物, A加热后生成的气体混合物若通过碱石灰,只剩余气体B(B为无色有刺激性气味的气体),若通过浓硫酸则只剩余气体D,回答列问题:
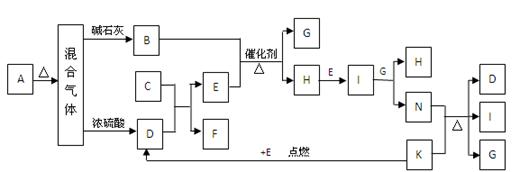
(1)写出C的电子式 。
(2)写出固体A的溶液与足量NaOH溶液反应的离子方程式
。
(3)写出实验室制取B的化学方程式
。
(4)写出N与K反应方程式
。
(5)火星探测车在火星大气中检测到了气体M。资料显示,M分子是三原子分子,其相对分子质量为60,在地球环境下M易分解。粉末状的KSCN与浓硫酸在一定条件下可得到气体M和两种硫酸氢盐,生成物的物质的量之比是1∶1∶1。则气体M的结构式是 。
K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体,且A是一种不含金属元素的盐,受热分解能得到三种物质的量相等的产物, A加热后生成的气体混合物若通过碱石灰,只剩余气体B(B为无色有刺激性气味的气体),若通过浓硫酸则只剩余气体D,回答列问题:
(1)写出C的电子式 。
(2)写出固体A的溶液与足量NaOH溶液反应的离子方程式
。
(3)写出实验室制取B的化学方程式
。
(4)写出N与K反应方程式
。
(5)火星探测车在火星大气中检测到了气体M。资料显示,M分子是三原子分子,其相对分子质量为60,在地球环境下M易分解。粉末状的KSCN与浓硫酸在一定条件下可得到气体M和两种硫酸氢盐,生成物的物质的量之比是1∶1∶1。则气体M的结构式是 。
分解水制氢气的工业制法之一是硫——碘循环,主要涉及下列反应:
I SO2+2H2O+I2→H2SO4+2HI
II 2HI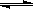 H2+I2
H2+I2
III 2H2SO4 → 2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是_________
a.反应III易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。

0—2min内的平均反应速率v(HI)=
_________ 。该温度下,反应2HI(g)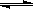 H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)SO2在一定条件下可氧化生成SO3,其主反应为:2SO2 (g) + O2(g)  2SO3(g)
+ Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
2SO3(g)
+ Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)

实际工业生产使用的条件是:常压、____________________________________选择该条件的原因是__________________。
(4)实际生产用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入18.4 mol/L的硫酸溶液的体积范围为______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com