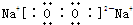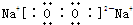A、Z、R、D、E、F、G是七种原子序数依次增大且不大于20的元素,其中有两种非金属元素位于同一主族.己知A、Z、D均能与R形成原子(或离子)个数不同的儿种常见化合物.请回答下列有关问题.
(1)若X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14,则X、Y的晶体熔点相对高低为(写化学式)
NaOH>HClO4
NaOH>HClO4
,导致这种差异存在的原因是
NaOH为离子晶体,HClO4形成分子晶体,离子键强于分子间作用力
NaOH为离子晶体,HClO4形成分子晶体,离子键强于分子间作用力
在相同温度下,相等物质的量浓度的X、Y各自的溶液中,由水电离出的c(H
+)的相对大小关系为
相等
相等
.
(2)A与Z、E均可形成正四面体构型的气态分子Q、P,又知P的燃烧热为1430kJ/mol.则其燃烧的热化学方程式
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l),△H=1430kJ/mol
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l),△H=1430kJ/mol
.
(3)R与D、F间;R与F、G间均可形成多种化合物,其中有两种是目前广泛使用的具有消毒杀菌能力的化合物.则相同物质的量浓度的这两种物质的溶液,消毒杀菌能力较强的物质的化学式为
Ca(ClO)2
Ca(ClO)2
,另一种物质的溶液中,各离子浓度由大到小的顺序为
Na+>ClO->OH->H+
Na+>ClO->OH->H+
.
(4)上述七种元素间能形成多种常见二元化合物,其中Z与G形成的一种化合物存在两类化学键的物质溶于HCl溶液的化学反应方程式为
CaC2+2HCl=CaCl2+C2H2↑;
CaC2+2HCl=CaCl2+C2H2↑;
,ZR
2的电子式是
,该分子的空间构型为
直线型
直线型
化合物ZRF
2的结构式为
(5)R能形成多种单质,如R
2、R
3,研究表明,新近制得的一种组成为R
4的分子中,每个R原子均与另外两个R原子各形成一个键,则1molR
4中共用电子对数为
4
4
N
A,列有关R
4的说法中正确的是
③
③
①R
4与R
3、R
2互为同位素
②R
4不能与A、Z、D的单质反应
③R
4中各原予最外层均为8电子结构
④R
4是1种新型化合物.




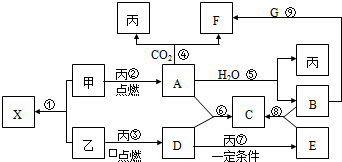






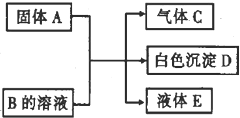 (2012?百色二模)A、B、C、D均为中学化学中的物质.它们间的反应关系如右图所示.
(2012?百色二模)A、B、C、D均为中学化学中的物质.它们间的反应关系如右图所示.