
题目列表(包括答案和解析)
已知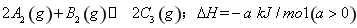 ,在一个有催化剂的固定容积的容器中加入2mol
,在一个有催化剂的固定容积的容器中加入2mol 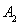 和1mol
和1mol 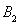 ,在500℃时充分反应达平衡后
,在500℃时充分反应达平衡后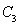 的浓度为w mol/L,放出热量b kJ。
的浓度为w mol/L,放出热量b kJ。
(1)比较a______b(填>、=、<)
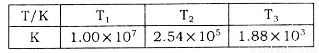
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
若在原来的容器中,只加入2mol 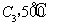 时充分反应达平衡后,吸收热量ckJ,
时充分反应达平衡后,吸收热量ckJ,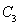 的浓度________(填>、=、<)w mol/L。
的浓度________(填>、=、<)w mol/L。
(3)在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mol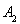 和2mol
和2mol ??????????? B.4mol
??????????? B.4mol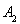 、2mol
、2mol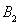 和2mol
和2mol 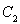
C.4mol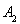 和4mol
和4mol ??????????? D.6mol
??????????? D.6mol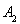 和4mol
和4mol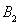
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是___________。
A.及时分离出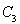 气体??????????? B.适当升高温度
气体??????????? B.适当升高温度
C.增大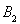 的浓度????????????? D.选择高效的催化剂
的浓度????????????? D.选择高效的催化剂
已知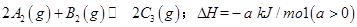 ,在一个有催化剂的固定容积的容器中加入2mol
,在一个有催化剂的固定容积的容器中加入2mol 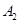 和1mol
和1mol 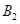 ,在500℃时充分反应达平衡后
,在500℃时充分反应达平衡后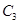 的浓度为w mol/L,放出热量b kJ。
的浓度为w mol/L,放出热量b kJ。
(1)比较a______b(填>、=、<)
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)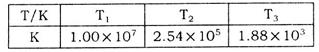
若在原来的容器中,只加入2mol 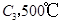 时充分反应达平衡后,吸收热量ckJ,
时充分反应达平衡后,吸收热量ckJ,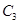 的浓度________(填>、=、<)w mol/L。
的浓度________(填>、=、<)w mol/L。
(3)在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4mol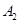 和2mol
和2mol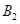 B.4mol
B.4mol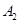 、2mol
、2mol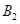 和2mol
和2mol 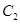
C.4mol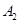 和4mol
和4mol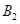 D.6mol
D.6mol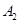 和4mol
和4mol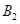
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是___________。
A.及时分离出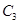 气体 B.适当升高温度
气体 B.适当升高温度
C.增大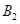 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂
 ,在一个有催化剂的固定容积的容器中加入2mol
,在一个有催化剂的固定容积的容器中加入2mol 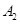 和1mol
和1mol 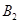 ,在500℃时充分反应达平衡后
,在500℃时充分反应达平衡后 的浓度为w mol/L,放出热量b kJ。
的浓度为w mol/L,放出热量b kJ。 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
 时充分反应达平衡后,吸收热量ckJ,
时充分反应达平衡后,吸收热量ckJ, 的浓度________(填>、=、<)w mol/L。
的浓度________(填>、=、<)w mol/L。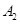 和2mol
和2mol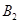 B.4mol
B.4mol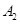 、2mol
、2mol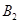 和2mol
和2mol 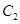
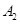 和4mol
和4mol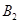 D.6mol
D.6mol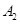 和4mol
和4mol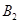
 气体 B.适当升高温度
气体 B.适当升高温度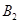 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
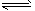 2NH3(g) ΔH=-92.2 kJ·mol-1。平衡时容器内气体压强为起始时的80%。
2NH3(g) ΔH=-92.2 kJ·mol-1。平衡时容器内气体压强为起始时的80%。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com