
题目列表(包括答案和解析)
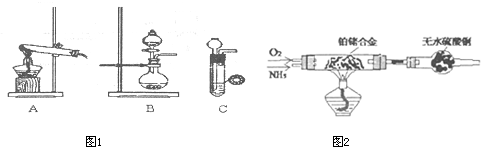
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ① |
| 乙小组 | ② |
浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
| ||
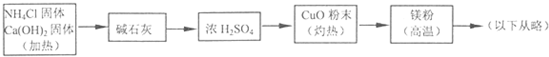
| 实验 序号 |
混合物 |
第一步: 加入适量水,充分溶解 |
第二步: 加入或通入的试剂 |
第三步: 过滤后洗涤干燥所得固体 |
第四步: 蒸发滤液得到晶体 |
第五步: 称量,记录数据 |
| 甲 | BaCl2 NaCl |
澄清溶液 | 过量CO2 | 无固体 | 晶体 | 称量所得晶体 |
| 乙 | CaCl2 NaCl |
澄清溶液 | 过量饱和Na2CO3溶液 | CaCO3 | NaCl | 称量蒸发所得晶体 |
| 丙 | Na2SO4 MgSO4 |
澄清溶液 | 过量NaOH溶液 |

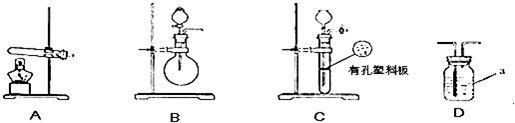
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com