
题目列表(包括答案和解析)
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)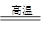 CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2 (g);ΔH=-393.5 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g);ΔH=-283.0 kJ·mol-1
H2(g)+1/2O2(g)=H2O(g);ΔH=-242.0 kJ·mol-1
请回答:
(1)根据以上信息,写出CO与水蒸气反应的热化学方程式:____________________________。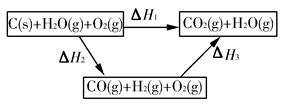
(2)如图是根据盖斯定律做出的循环图,根据图的转化关系和热化学方程式计算ΔH3=________kJ/mol。
请比较ΔH1与ΔH3数值是否可以说明用水煤气做燃料要比直接燃煤放出的热量多________(是或否)原因是___________________________________。
(3)目前煤的运输还主要靠铁路运输和公路运输,你能在所学知识基础上提出缓解铁路和公路运输的方法:____________________________。
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2 (g);ΔH=-393.5 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g);ΔH=-283.0 kJ·mol-1
H2(g)+1/2O2(g)=H2O(g);ΔH=-242.0 kJ·mol-1
请回答:
(1)根据以上信息,写出CO与水蒸气反应的热化学方程式:____________________________。
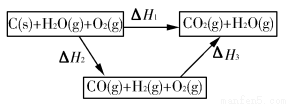
(2)如图是根据盖斯定律做出的循环图,根据图的转化关系和热化学方程式计算ΔH3=________kJ/mol。
请比较ΔH1与ΔH3数值是否可以说明用水煤气做燃料要比直接燃煤放出的热量多________(是或否)原因是___________________________________。
(3)目前煤的运输还主要靠铁路运输和公路运输,你能在所学知识基础上提出缓解铁路和公路运输的方法:____________________________。
 CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
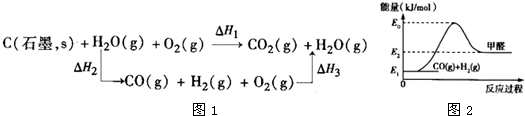
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com