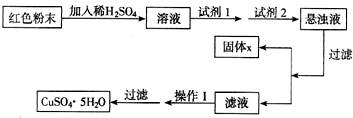
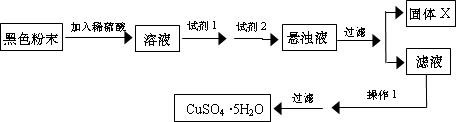
(2011?清城区一模)已知:Cu
2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO
4.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某化学兴趣小组通过实验来探究某红色粉末是Fe
2O
3或Cu
2O或两者的混合物.(实验所需试剂只能从下列中选择:稀硫酸、KSCN溶液、稀硝酸、双氧水、铁粉、碱式碳酸铜)
探究方案:将红色粉末溶于足量的稀硫酸中;实验现象:反应后有红色固体存在;
(1)结论:红色粉末是
Cu2O或Fe2O3和Cu2O的混合物
Cu2O或Fe2O3和Cu2O的混合物
.
(2)如果红色粉末是Cu
2O和少量Fe
2O
3的混合物,请设计实验证明之.
实验操作:
取少许红色粉末溶于足量稀硫酸中,充分溶解后滴加KSCN溶液,再滴加双氧水
取少许红色粉末溶于足量稀硫酸中,充分溶解后滴加KSCN溶液,再滴加双氧水
实验现象:
有红色固体生成,加KSCN溶液不显红色,再加双氧水后显红色
有红色固体生成,加KSCN溶液不显红色,再加双氧水后显红色
(3)兴趣小组欲利用Fe
2O
3和Cu
2O的混合物制取较纯净的胆矾(CuSO
4?5H
2O).经查阅资料得知:在溶液中通过调节溶液的酸碱性而使Cu
2+、Fe
2+、Fe
3+分别生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀的pH |
6.4 |
9.7 |
1.9 |
| 沉淀完全的pH |
9.6 |
12.7 |
3.7 |
实验小组设计如下实验方案:

试回答:
①试剂1为
双氧水
双氧水
,试剂2为
碱式碳酸铜
碱式碳酸铜
(填名称);
加入试剂1后发生反应的离子方程式为
Cu+H2O2+2H+═Cu2++2H2O
Cu+H2O2+2H+═Cu2++2H2O
,
2Fe2++H2O2+2H+═2Fe3++2H2O
2Fe2++H2O2+2H+═2Fe3++2H2O
.
②固体X的化学式为
Fe(OH)3
Fe(OH)3
;
③操作1为
蒸发浓缩、冷却结晶
蒸发浓缩、冷却结晶
.