
题目列表(包括答案和解析)
 )等污染物的废水流入松花江,最终经俄罗斯入海.
)等污染物的废水流入松花江,最终经俄罗斯入海.

3- 4 |
| A、酒精中是否含有水,可用金属钠检验 | B、除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏 | C、分子式为C4H10O并能与金属钠反应放出氢气的有机化合物有3种 | D、用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 |
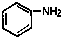
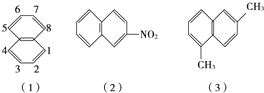 苯环上的碳原子的编号如(1)式,根据系统命名法,(2)式可称为2硝基萘,则化合物(3)的名称应是( )
苯环上的碳原子的编号如(1)式,根据系统命名法,(2)式可称为2硝基萘,则化合物(3)的名称应是( )| △ |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com