
题目列表(包括答案和解析)

(08山东省淄博模拟)(18分)在用FeSO4溶液与NaOH溶液反应制备白色的Fe(OH)2时,出现了“白色沉淀迅速转变为灰绿色,最后逐渐变成红褐色”的实验现象,如何解释出现灰绿色的现象,探究小组的同学产生了不同的观点:
①灰绿色物质就是红褐色的氢氧化铁跟白色的氢氧化亚铁的简单混合物;
②灰绿色物质是铁的一种新的氢氧化物,但其中不含Fe3+离子。
(1)验证观点①不正确的实验操作是: ,
验证观点②所需的试剂有: 。
(2)某同学查阅资料后,得到Fe(OH)2如下信息:

阅读该资料后,你对上述实验中出现灰绿色的现象的解释是:__________。
探究小组的同学在研究由Fe2+制备Fe(OH)2的过程中,甲、乙、丙、丁四位同学分别设计了如下4个实验方案:
甲方案:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2。
乙方案:应用钢铁吸氧腐蚀的原理,设计电池制备Fe(OH)2。
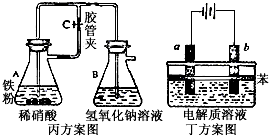
|
丙方案:按图实验,制备Fe(OH)2。 丁方案:按图实验,制备Fe(OH)2。(苯的作用是使电解质溶液隔绝空气)
回答下列问题:
①在甲方案中,所用FeSO4样品通常部分被氧化,写出在配制FeSO4溶液时,其操作过程及反应的离子方程式: 。
②在乙方案中,正极的电极反应式是: 。你认为该方案是否可行? ,若不可行请说明理由(若可行,则该空不需回答): 。
③在丙方案中,当容器B、A中均加入试剂并塞好橡皮塞后,还需要进行的操作是 。
④在丁方案中,在两电极之间的溶液中首先观察到白色沉淀。请写出b电极的电极反应式: 。则其电解质溶液可以是下列三项的 。
A.蒸馏水 B.NaC1溶液 C.NaOH溶液

I.类比法是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是 Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生称FeCl3,当铁粉过量时产物是FeCl2,为了验证该观点是否正确,该同学将一定量的铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
⑴提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是
⑵设计实验方案:
取少量固体物质置于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:
实验方法 | 实验现象 | 结论 |
在溶液中加KSCN溶液 |
| 固体物质中有FeCl3 |
在KMnO4溶液中加少量A 溶液 | KmnO4溶液颜色无明显变化 | 固体物质中不含 |
Ⅱ.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤:

⑶①写出一个能证明还原性Fe比Cu强的离子方程式: ,该反应在上图步骤 中发生。
②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示:


四位同学的设计的原电池装置图,符合上述反应原理的是 。
③请写出正、负极的电解反应式:
正极: 、负极: (电极反应式)。
⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式
(08龙岩一中模拟)(15分)在用FeSO4溶液与NaOH溶液反应制备白色的Fe(OH)2时,出现了“白色沉淀迅速转变为灰绿色,最后逐渐变成红褐色”的实验现象,如何解释出现灰绿色的现象,探究小组的同学产生了不同的观点:
①灰绿色物质就是红褐色的氢氧化铁跟白色的氢氧化亚铁的简单混合物;
②灰绿色物质是铁的一种新的氢氧化物,但其中不含Fe3+离子。
(1)验证观点①不正确的实验操作是: ,
验证观点②所需的试剂有: 。
(2)探究小组的同学在研究由Fe2+制备Fe(OH)2的过程中,甲、乙、丙、丁四位同学分别设计了如下4个实验方案:
甲方案:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2。
乙方案:应用钢铁吸氧腐蚀的原理,设计电池制备Fe(OH)2。
丙方案:按图实验,制备Fe(OH)2。
|
丁方案:按图实验,制备Fe(OH)2。
回答下列问题:
① 在甲方案中,所用FeSO4样品通常部分被氧化,写出在配制FeSO4溶液时,其操作过程:
② 在乙方案中,正极的电极反应式是: 。你认为该方案是否可行? 若不可行请说明理由(若可行,则该空不需回答):
③ 在丙方案中,当容器B、A中均加入试剂并塞好橡皮塞后,还需要进行的操作是 。
④ 在丁方案中,在两电极之间的溶液中首先观察到白色沉淀。请写a电极的电极反应式: 。则其电解质溶液可以是下列三项的 。
A.蒸馏水 B.NaC1溶液 C.NaOH溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com