
题目列表(包括答案和解析)

(11分) 铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
(1)钴原子的基态电子排布式为_____________________ _____________。
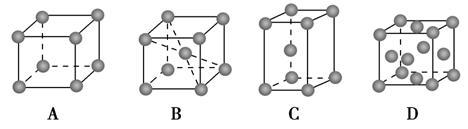
(2)金属铬的堆积方式属于A2型,其晶胞示意图为________(填序号)。

(3)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5 ℃,沸点117 ℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①固态CrO2Cl2属于______ __晶体;
②丙酮中碳原子采取的杂化方式为_ __;
③CS2属于____ _ ___(填“极性”或“非极性”)分子。
(4)+3价铬的配合物K[Cr(C2O4)2(H2O)2]中,配体是________________,与C2O42—互为等电子体的分子是(填化学式)___ _____。
(5)CrCl3·6H2O(相对分子质量为266.5)有三种不同颜色的异构体:[Cr(H2O)6]Cl3、[Cr(H2O)5Cl]Cl2·H2O和[Cr(H2O)4Cl2]Cl·2H2O。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665 g CrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435 g。该异构体为_________ ___________(填化学式)。
(11分) 铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
(1)钴原子的基态电子排布式为_____________________ _____________。
(2)金属铬的堆积方式属于A2型,其晶胞示意图为________(填序号)。

(3)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5 ℃,沸点117 ℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①固态CrO2Cl2属于______ __晶体;
②丙酮中碳原子采取的杂化方式为_ __;
③CS2属于____ _ ___(填“极性”或“非极性”)分子。
(4)+3价铬的配合物K[Cr(C2O4)2(H2O)2]中,配体是________________,与C2O42—互为等电子体的分子是(填化学式)___ _____。
(5)CrCl3·6H2O(相对分子质量为266.5)有三种不同颜色的异构体:[Cr(H2O)6]Cl3、[Cr(H2O)5Cl]Cl2·H2O和[Cr(H2O)4Cl2]Cl·2H2O。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665 g CrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435 g。该异构体为_________ ___________(填化学式)。
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为﹣96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶。
(1)写出Fe(26号元素)原子的基态电子排布式为 。
(2)CH3COCH3分子中含有 个π键,含有 个δ键。
(3)固态氯化铬酰属于 晶体,丙酮中碳原子的杂化方式为 ,二硫化碳属于 (填极性”或“非极性”)分子。
(4)K[Cr(C2O4)2(H2O)2]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有有 键。
(5)金属铬的晶胞如下图所示,一个晶胞中含有 个铬原子。

 [化学--选修物质结构与性质]不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.
[化学--选修物质结构与性质]不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com