
题目列表(包括答案和解析)


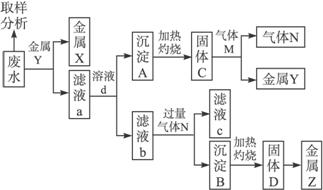
回答下列问题:
(1)固体C的化学式为____________,滤液b中通入过量气体N发生反应的离子方程式为____________________________________,固体D转化为金属Z的化学方程式为________________________。
(2)取样分析废水中Ag+、Fe3+、Al3+的含量,目的是____________。
a.控制溶液中Ag+、Fe3+、Al3+含量比 b.确定下一步加入金属Y的量
c.确定滤液a中加入溶液d的量 d.确定沉淀A转化为固体C所需的温度
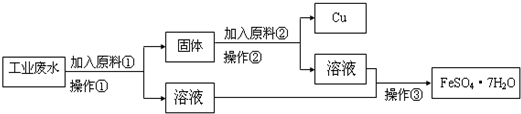
(8分)某工厂排出的废水中含有大量的Fe2+、Cu2+和SO 。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。

请回答:
(1)原料①为 。
(2)写出加入原料②后反应的离子方程式:____。
(3)该流程若在实验室中完成,操作②需要用到的玻璃仪器的名称是 ;操作③需要用到的下列实验装置是 (填字母)。

(8分)某工厂排出的废水中含有大量的Fe2+、Cu2+和SO 。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
请回答:
(1)原料①为 。
(2)写出加入原料②后反应的离子方程式:____。
(3)该流程若在实验室中完成,操作②需要用到的玻璃仪器的名称是 ;操作③需要用到的下列实验装置是 (填字母)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com