
(2010?福建)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)M的离子结构示意图为
;元素T在周期表中位于第
ⅦA族
ⅦA族
族.
(2)J和氢组成的化合物分子有6个原子,其结构简式为
CH2=CH2
CH2=CH2
.
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为
AlCl
3+3H
2O

Al(OH)
3+3HCl
AlCl
3+3H
2O

Al(OH)
3+3HCl
.
(4)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H
2O
2 的清除剂,所发生反应的产物不污染环境,其化学方程式为
2NH3?H2O+3H2O2=N2+8H2O
2NH3?H2O+3H2O2=N2+8H2O
.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是
ac
ac
(选填序号).
| 选项 |
a |
b |
c |
d |
| x |
温度 |
温度 |
加入N2的物质的量 |
加入甲的物质的量 |
| y |
甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
(5)由J、R形成的液态化合物JR
2 0.2mol在O
2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ. 该反应的热化学方程式为
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol
.

 (2010?福建)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(2010?福建)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.

 Al(OH)3+3HCl
Al(OH)3+3HCl Al(OH)3+3HCl
Al(OH)3+3HCl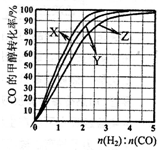 (2009?南京二模)工业上可利用合成气(CO和H2的混合气体)生产甲醇(如反应④).已知:
(2009?南京二模)工业上可利用合成气(CO和H2的混合气体)生产甲醇(如反应④).已知: (2011?肇庆二模)二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
(2011?肇庆二模)二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.