分氨气是中学化学中常见的气体,其用途广泛。
(1)实验室制取氨气的化学方程式是
。
(2)工业上氨气可以由氢气和氮气合成。

①该反应的热化学方程式是
。
②简述一种检查氨气是否泄露可采用的化学方法:
。
(3)下表是当反应器中按n(N
2):n(H
2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH
3的物质的量分数随压强的变化曲线。
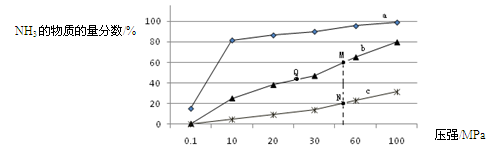
①曲线a对应的温度是
。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A. 及时分离出NH
3可以提高H
2的平衡转化率
B. 加催化剂能加快反应速率且提高H
2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③ M点对应的H
2转化率是
。
(4)工业制硫酸的尾气中含较多的SO
2,为防止污染空气,回收利用SO
2,工业上常用
氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO
2时,溶液中的溶
质为
。
② (NH
4)
2SO
3显碱性,用化学平衡原理解释
。
③ NH
4HSO
3显酸性。用氨水吸收SO
2,当吸收液显中性时,溶液中离子浓度关系正确
的是
(填字母)。
a.c(NH
4+) = 2c(SO
32-) + c(HSO
3-)
b.c(NH
4+)> c(SO
32-)> c(H
+)= c(OH
-)
c.c(NH
4+)+ c(H
+)= c(SO
32-)+c(HSO
3-)+c(OH
-)
(5)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:

①氨气燃料电池的电解质溶液最好选择
(填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是
。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是
,正极的电极反应方是
。



