
题目列表(包括答案和解析)
| A.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
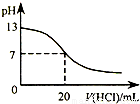
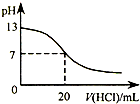
| B.图表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液,溶液的pH随加入酸体积的变化 |
| C.在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12 |
| D.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
 (2012?浙江模拟)下列说法正确的是( )
(2012?浙江模拟)下列说法正确的是( )| Fe2O3 | CO | Fe | CO2 | |
| 甲 | 1.0mol | 1.0mol | 1.0mol | 1.0mol |
| 乙 | 1.0mol | 2.0mol | 1.0mol | 1.0mol |
| 实验操作 | 预期现象及结论 |
| 步骤1:取少量样品于烧杯中加适量稀硫酸溶解 | \ |
| 步骤2: 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 |
若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 |
| 步骤3: 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 |
若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 |
| 步骤4: 空 空 |
空 空 |
 (2010?卢湾区二模)373K时,某1L密闭容器中发生如下可逆反应:A(g)?2B(g).其中物质B的物质的量变化如图所示.
(2010?卢湾区二模)373K时,某1L密闭容器中发生如下可逆反应:A(g)?2B(g).其中物质B的物质的量变化如图所示.| c2(B) |
| c(A) |
| c2(B) |
| c(A) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com