
题目列表(包括答案和解析)
(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
|
n(SO3²﹣):n(HSO3﹣) |
91 :9 |
1 :1 |
1 :91 |
|
pH |
8.2 |
7.2 |
6.2 |
①上表判断NaHSO3溶液显 性,从原理的角度解释原因
②在NaHSO3溶液中离子浓度关系不正确的是(选填字母):
A.(Na+)= 2c(SO32-)+ c(HSO3-),
B.(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-),
C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-),
D.(Na+)+ c(H+)= 2 c(SO32-)+ c(HSO3-)+ c(OH-)
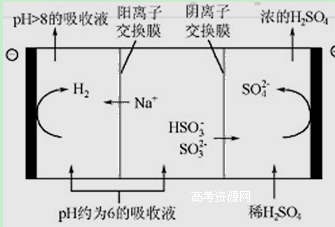
(4)当吸收液的pH降至约为6时,需送至电解槽再生 。再生示意图如下:

① 吸收液再生过程中的总反应方程式是 。
② 当电极上有1mol电子转移时阴极产物为 克.
(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO3²﹣):n(HSO3﹣) | 91 :9 | 1 :1 | 1 :91 |
| pH | 8.2 | 7.2 | 6.2 |
(14分)A、B、C、D、E、F 是六种短周期的主族元素,它们的原子序数依次递增;A元素与其它元素均不在同一周期,C元素与B、D元素同周期相邻;C元素的最高价氧化物对应水化物与C元素的气态氢化物X能相互反应生成盐Y;D、F元素同族,E是短周期主族中原子半径最大的元素。请完成下列问题:
(1)D位于元素周期表第__________周期__________族。
(2)E原子的结构示意图为__________。
(3)D和F两元素相比较,非金属性较强的是__________填元素名称),可以验证该结论的事实是__________________________________________________(只写一个即可)。
(4)A、D和E三种元素组成的化合物,其所含的化学键类型有____________________。
(5)检验X的试剂或试纸是__________。
(6)由A、C、D三种元素组成的两种强电解质甲和乙,它们的水溶液均呈酸性。若甲抑制水的电离,则甲的化学式为__________ ;若乙促进水的电离,则乙的水溶液呈酸性的原因是(用离子方程式表示)______________________________________________。
(7)写出D、E两元素形成的原子个数比为1:1的化合物与水反应的化学方程式:
____________________________________________________________ 。
(8)A与D间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的离子方程式__________________________________________________。
(9)已知0.4mol 液态C2 A4与液态双氧水反应,生成C2和液态水,放出327.2 kJ的热量,该反应的热化学方程式为__________________________________________________。
(10)D、E、F简单离子半径由大到小的顺序为:______________________________(用离子符号表示)。
(11)写出A、D两种元素形成的化合物的一种用途______________________________。
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾履形成的原因。
(1)汽车尾气净化的主要原理为;2NO(g)+2CO(g)  N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____。
A.在单位时问内生成1mol CO2的同时消耗了lmol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
?? 
③若要同时提高该反应的速率和NO的转化率,采取的措施有_____、____。(写出2个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应原理为C(s)+H2O(g) CO(g)+H2(g) △H=+131.3kJ/mol。
CO(g)+H2(g) △H=+131.3kJ/mol。
①该反应在___下能自发进行(填“高温”或“低温”)。
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为____。(已知:H2S: Ka1=9.1×10-8;Ka2=1.1×10-12。H2CO3:Ka1=4.30×10-7;Ka2=5.61×10-11)
(3)已知反应:CO(g)+H2O(g) CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=______(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ______0(填“<”或“>”);若在9000C时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时υ正______υ逆(填“<”,“>”,“=”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com