
题目列表(包括答案和解析)
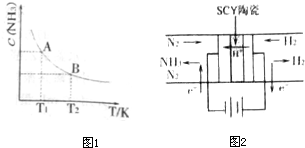

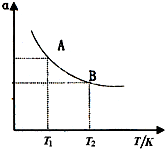
 (2009?清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)?2NH3(g) 已知298K时:△H=-92.4kJ?mol-1试回答下列问题:
(2009?清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)?2NH3(g) 已知298K时:△H=-92.4kJ?mol-1试回答下列问题:| 0.082 |
| 0.06×0.183 |
| 0.082 |
| 0.06×0.183 |
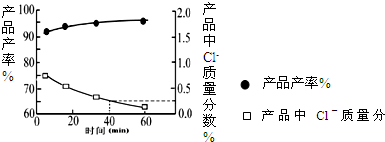
 2NH3,则在电化学合成氨的过程中,阴极反应式为______;
2NH3,则在电化学合成氨的过程中,阴极反应式为______;| 时间/min 浓度/mol.L | c (N2) | c (H2) | c (NH3) |
| 0.6 | 1.8 | ||
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com