四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.
(1)某种粗盐含有少量Ca
2+、Mg
2+、Fe
3+、SO
等杂质离子,实验室提纯该粗盐的流程如下:
粗盐溶解
滤液
纯NaCl
提供的试剂有:a.饱和Na
2CO
3溶液 b.饱和K
2CO
3溶液
c.NaOH溶液 e.Ba(NO
3)
2溶液 d.BaCL
2溶液
①欲除去粗盐溶液中的Ca
2+、Mg
2+、Fe
3+、SO
离子,所加试剂的顺序依次为(填序号)
dca(或dac,或cda)
dca(或dac,或cda)
②蒸发时所用玻璃棒的作用是
搅拌,防止液体飞溅
搅拌,防止液体飞溅
,蒸发操作即将结束,当
溶液中有大量晶体析出
溶液中有大量晶体析出
时,停止加热,熄灭酒精灯.
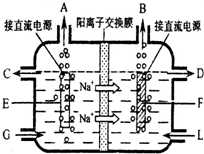
(2)食盐是工业上生产氯气和烧碱的重要原料.右图是工业上电解饱和和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成).
①B处出口产生的物质是
H2
H2
;G处进口的物质是
精制的饱和食盐水
精制的饱和食盐水
.电解总反应的离子方程式为
.
②如果开始就将直流电源的正负极与电极接反了,通电几分钟,在电极F附近可以观察到的现象是
溶液中产生白色沉淀,随后沉淀变为灰绿色,甚至变为红褐色,碳钢网电极被腐蚀
溶液中产生白色沉淀,随后沉淀变为灰绿色,甚至变为红褐色,碳钢网电极被腐蚀
.
(3)采用无膜电解槽电解饱和食盐水(离子交换膜更换为搅拌器),可制取次氯酸钠溶液作消毒液.实验室在常温下电解饱和食盐水v
1mL(密度为ρg/cm
3),当收集到v
2L标准状况下的H
2时,理论上所得混合溶液中次氯酸钠的质量分数计算式为
.

 四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.
四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.