
题目列表(包括答案和解析)
元素周期表是人们研究物质性质的重要工具,下表是元素周期表的一部分,请用化学用语回答下列问题:
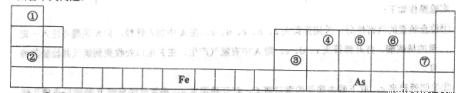
(1)①—⑦号元素原子半径最大的是____,最高价氧化物对应的水化物物酸性最强的是________________.
(2)写出由①-⑦号元素中的几种组成显碱性的盐的化学式____________________。(写出2种即可),并用离子方程式表示其中一种显碱性的原因____________________.
(3)写出③号元素的最高价氧化物与①-⑦号元素中金属性最强的元素的最高价氧化物的水化物反应的离子方程式_____________________。
(4) As在元素周期表中的位置是________________。
⑸As的原子结构示意图为________,其氢化物的电子式为___________.
(6)Y是由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂。As可以与Y的水溶液反应,生成其最高价含氧酸(H3AsO4 ),写出该反应的离子方程式_____________________,
当消耗1mol还原剂时转移电子的物质的量为______________________。
元素周期表是人们研究物质性质的重要工具,下表是元素周期表的一部分,请用化学用语回答下列问题: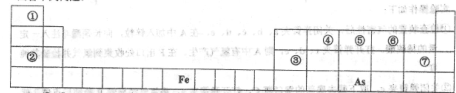
(1)①—⑦号元素原子半径最大的是____,最高价氧化物对应的水化物物酸性最强的是________________.
(2)写出由①-⑦号元素中的几种组成显碱性的盐的化学式____________________。(写出2种即可),并用离子方程式表示其中一种显碱性的原因____________________.
(3)写出③号元素的最高价氧化物与①-⑦号元素中金属性最强的元素的最高价氧化物的水化物反应的离子方程式_____________________。
(4) As在元素周期表中的位置是________________。
⑸As的原子结构示意图为________,其氢化物的电子式为___________.
(6)Y是由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂。As可以与Y的水溶液反应,生成其最高价含氧酸(H3AsO4 ),写出该反应的离子方程式_____________________,
当消耗1mol还原剂时转移电子的物质的量为______________________。

(1)①在次氯酸钠溶液中加入固体烧碱形成碱性环境。
①将研磨后的硝酸铁少量多次地加入到上述溶液中,冰浴中反应1h。该反应的离子方程式为_______________________。
②将KOH加入到反应后的溶液中搅拌半小时。静置,抽滤粗产品。该反应的化学方程式为______________________;推测该反应发生的理由是______________________。
④依次用甲苯、乙醇、乙醚洗涤以除去水分和KNO3、KCl、KOH等杂质。
(2)在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价格)。现称取5.00g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液和稍过量的KCrO2,充分反应后,转移到250mL容量瓶中,定容。量取25.00mL溶液,用稀硫酸酸化后,用0.1000 mol·L-1的(NH4)2Fe(SO4)2标准溶液进行滴定,共用去标准溶液33.33mL。
①用离子方程式表示标准溶液显酸性的原因:____________________。
②用离子方程式表示上述滴定反应原理:______________________;如果滴定过程中,剧烈振荡,会使部分亚铁离子被空气中的氧气氧化,导致实验结果偏低。写出亚铁离子在酸性条件下被空气中氧气氧化的离子方程式:______________________。
③上述实验制得的样品中高铁酸钾的质量分数为____________________。


| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com