
题目列表(包括答案和解析)
(1)常温下pH=2的盐酸中水电离出的c(H+)= ;
常温下pH=9的醋酸钠溶液中水电离出的c(OH-)= 。
(2)下列溶液中分别加入MgCO3溶解至饱和,溶解MgCO3较多的是(请填编号) 。①20mL0.1mol/L Na2CO3溶液,②20mL0.2mol/L MgCl2溶液。
(3)0.2mol/L NaHCO3溶液与0.1mol/LNaOH溶液等体积混合后,溶液中各阴离子的浓度由大到小的顺序是 ,含碳元素的粒子的浓度之和(忽略溶液体积的变化)= 。
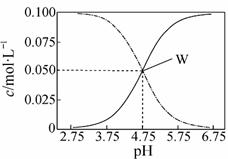
(4)25℃,有c(CH3COOH)+c(CH3COO-)=0.1
mol·L-1的一组醋酸和醋酸钠混合溶液,
溶液中c(CH3COOH)、c(CH3COO-)与pH值
的关系如右图所示。W点时溶液中的c(Na+)、
c(CH3COOH)、c(H+),最大的是 ,
最小的是 。
(5)常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,不可能显碱性的是(填“a”或“b”) 。
下列叙述中正确的是( )
A.将pH = 3的一元弱酸HA和pH = 11的NaOH溶液混合后溶液显碱性,一定有:
c(H+) < c(OH- )< c(A-) <c(Na+)
B.在常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,体积为20 mL,则溶液的pH = 12+lg2
C.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:
c(CH3COONa)>c(C6H5ONa )>c(Na2CO3)>c(NaOH )
D.将0.2 mol·L-1的盐酸与0.1 mol·L-1的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(Na+)<c(Cl-)
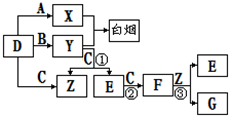 下图所示(反应条件均已略去).
下图所示(反应条件均已略去).
| ||
| △ |
| ||
| △ |
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。
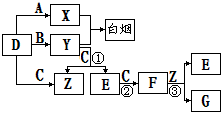
请回答下列问题:
⑴D的化学式为 。
⑵反应③的离子方程式为 。
⑶Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
⑷0.1 mol·L-1的X溶液和0.1 mol·L-1的Y溶液等体积混合,溶液呈________性(填“酸”、“碱”或“中”),原因是_______________________________________(用离子方程式说明)。
⑸常温下0.1 mol·L-1的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是( )
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1 mol·L-1
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1 mol·L-1的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH为9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com