
题目列表(包括答案和解析)
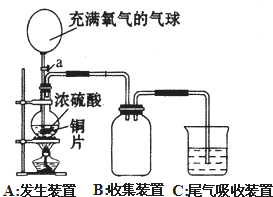 小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧杯中不再有气泡产生时,停止反应,此时烧瓶中铜片仍有剩余.再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失.
小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧杯中不再有气泡产生时,停止反应,此时烧瓶中铜片仍有剩余.再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失.
| ||
| ||
| ||
| ||
| ||
| ||

| ||
| △ |
| ||
| △ |
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| … |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,滴加足量1moL?L-1 H2SO4至固体溶解,然后将内壁附有澄清石灰水的烧杯罩于试管口. | 若澄清石灰水未见浑浊,则假设1成立; 若澄清石灰水变浑浊,则______ ______ |
| 步骤2: | |
| 步骤3: |
| 实验操作 | 预期现象和结论 |
| 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤. | 粉末减少,说明粉末可能含有Al2O3 |
| 步骤2:取少量步骤1的滤液于试管中,逐滴滴加3mol/L盐酸至过量. | ______, 说明粉末中含有Al2O3. |
| 步骤3:将步骤1的滤渣转移到烧杯B中,加入足量3mol/L CuSO4,充分搅拌,过滤,洗涤. | 有红色固体生成,说明粉末中含有______. |
| 步骤4:______ | ______ |
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么![]() (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量![]() m(H20),由此计算
m(H20),由此计算![]() 。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):

请回答下列问题:[来源:学§科§网Z§X§X§K]
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大![]() 的是_______________ (填序号);
的是_______________ (填序号);
![]() Cu0未完全起反应 ② CuO不
Cu0未完全起反应 ② CuO不![]() 干燥
干燥
![]() Cu0中混有不反应的杂质 ④ 碱石灰不干燥
Cu0中混有不反应的杂质 ④ 碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或__________![]() _____和_______________达到实验目的。
_____和_______________达到实验目的。
选考题(请考生在第18、19、20三题中任选一题做答,如果多做,则按所做的第一题计分。做答时用2B铅笔在答题卡上把所选题目的题号涂黑)。
第18、19、20三题的第Ⅰ题为选择题,在给出的四个选项中,至少有两项是符合
题目要求的,请将符合题目要求的选项标号填在答题卡相应位置;第Ⅱ题为非选择题,
请在答题卡相应位置做答并写明小题号。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com