
题目列表(包括答案和解析)
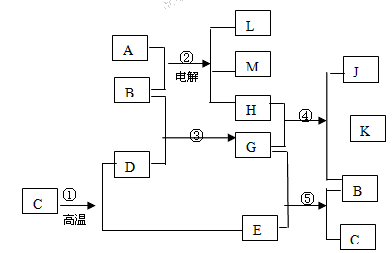
(12分)根据反应框图填空,已知反应①~⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。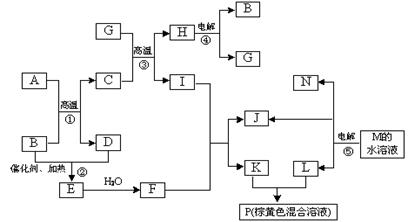
(1)I元素在元素周期表中的位置_ ______;M中阴离子的结构示意图: 。
(2)固体A中所包含的化学键与固体Na2O2类似,则A的电子式为 。
(3)写出反应①所使用设备的名称___________________。
(4)写出下列化学反应的离子方程式:
① 反应⑤:______________________________________________ ___;
② G与N的反应:________________________________________________;
③ K与L的反应:________________________________________________。
(5)已知每生成16 gD,放出106.5 kJ热量,则反应① 的热化学方程式为:
的热化学方程式为:
。
(12分)根据反应框图填空,已知反应①~⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。
(1)I元素在元素周期表中的位置_ ______;M中阴离子的结构示意图: 。
(2)固体A中所包含的化学键与固体Na2O2类似,则A的电子式为 。
(3)写出反应①所使用设备的名称___________________。
(4)写出下列化学反应的离子方程式:
① 反应⑤:______________________________________________ ___;
② G与N的反应:________________________________________________;
③ K与L的反应:___________________________________ _____________。
(5)已知每生成16 gD,放出106.5 kJ热量,则反应①的热化学方程式为:
。
根据反应框图填空,已知反应①~⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120,M为海水中含量最多的无机盐。
(1)I元素在元素周期表中的位置 ;M中阴离子的结构示意图: 。
(2)固体A中所包含的化学键与固体Na2O2类似,则A的电子式为 。
(3)写出下列化学反应的离子方程式:
① 溶液P与KSCN溶液:_____________________________________ ___;
② G与N的反应:______________________________________ __________;
③ K与L的反应:___________________________________ _____________。
(4)已知每生成16 gD,放出106.5 kJ热量,则反应①的热化学方程式为:
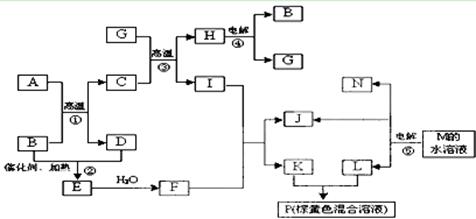
根据反应框图填空,已知反应①~⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120,M为海水中含量最多的无机盐。

(1)I元素在元素周期表中的位置 ;M中阴离子的结构示意图: 。
(2)固体A中所包含的化学键与固体Na2O2类似,则A的电子式为 。
(3)写出下列化学反应的离子方程式:
① 溶液P与KSCN溶液:_____________________________________ ___;
② G与N的反应:______________________________________ __________;
③ K与L的反应:___________________________________ _____________。
(4)已知每生成16 gD,放出106.5 kJ热量,则反应①的热化学方程式为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com