
题目列表(包括答案和解析)
[ ]
(1)已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
H2(g)=H2(l) ΔH=-0.92 kJ·mol-1
O2(g)=O2(l) ΔH=-6.84 kJ·mol-1
H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧反应生成气态水的热化学方程式:__________________________
电解质溶液为KOH溶液的氢氧燃料电池,其负极的电极反应式为____________________________________。
(2)如图表示373 K时,反应A(g) 2B(g)在前110 s内的反应进程。
2B(g)在前110 s内的反应进程。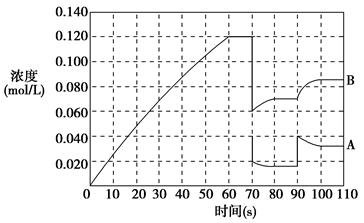
①此反应的平衡常数表达式K=________。
②373 K时反应进行到70 s时,改变的条件可能是________,反应进行到90 s时,改变的条件可能是________。
| A.加入催化剂 | B.扩大容器体积 | C.升高温度 | D.增大A的浓度 |
 2B(g)在前110 s内的反应进程。
2B(g)在前110 s内的反应进程。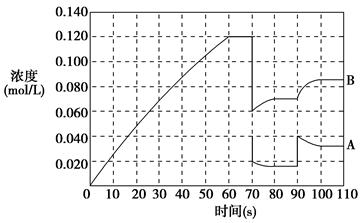
| A.加入催化剂 | B.扩大容器体积 | C.升高温度 | D.增大A的浓度 |
|
已知:H2(g)+O2(g)=H2O(l);ΔH=-285.8 kJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890 kJ·mol-1 现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695 kJ,则原混合气体中H2与CH4的物质的量之比是 | |
| [ ] | |
A. |
1∶1 |
B. |
2∶3 |
C. |
1∶4 |
D. |
1∶3 |
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) === 2CO2(g)+2H2O(l) △H1= -870.3 kJ·mol-1
(2)C(s)+O2(g) === CO2(g) △H2= -393.5 kJ·mol-1
(3)H2(g)+O2(g) === H2O(l) △H3= -285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l) 的焓变△H为( )kJ·mol-1
A.488.3 B.-244.15 C.244.15 D.-488.3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com