
题目列表(包括答案和解析)
某核素R具有微弱放射性,其原子核内的中子数比质子数多43,由它组成的固体单质A,在一定条件下密度为6.88g· ,用X射线研究其固体表明,在边长为1.00×
,用X射线研究其固体表明,在边长为1.00× 的立方体中含有20个原子.R在化学反应中常表现为+2价、+4价.在溶液中
的立方体中含有20个原子.R在化学反应中常表现为+2价、+4价.在溶液中 稳定,而
稳定,而 有强氧化性,可将NO氧化为
有强氧化性,可将NO氧化为 .氧化物
.氧化物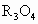 ,其性质与
,其性质与 有些类似.R的另一种质量数比R少2的同位素较为稳定,与铁可形成合金,在潮湿环境中易形成铁锈.R的单质及化合物在工农业生产、医疗卫生、科学技术等各个领域都有很多用途.
有些类似.R的另一种质量数比R少2的同位素较为稳定,与铁可形成合金,在潮湿环境中易形成铁锈.R的单质及化合物在工农业生产、医疗卫生、科学技术等各个领域都有很多用途.
请回答:
(1)R原子的摩尔质量为________.
(2)R元素处于周期表中第________周期________族.
(3)假若把少量 加到
加到 溶液中,是否会发生反应?
溶液中,是否会发生反应?
若“否”,其原因为:________.
若“是”,其离子反应方程式为:________
(4)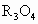 因具有氧化性,而大量用于油漆涂料,涂在钢铁表面,有利于形成耐腐蚀的钝化层.
因具有氧化性,而大量用于油漆涂料,涂在钢铁表面,有利于形成耐腐蚀的钝化层.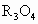 与足量的
与足量的 反应,生成R的氧化物、R的硝酸盐和水三种物质,此反应的方程式为________.
反应,生成R的氧化物、R的硝酸盐和水三种物质,此反应的方程式为________.
| |||||||||||||||||||
(1)R原子的摩尔质量为__________;R在周期表中第周__________期第__________族。?
(2)假若把少量的R4+加到FeCl2溶液中是否发生反应?若不反应,说明理由;若反应,写出其离子方程式______________________________________________________________。
(3)R3O4被大量用于油漆涂料,涂在钢铁表面有利于形成耐腐蚀的钝化层。R3O4与足量的硝酸反应,生成R的氧化物,R的硝酸盐和水三种物质,此反应的化学方程式为__________________________________________________________________。?
(1)R原子的摩尔质量为________.
(2)R元素处于周期表中第________周期________族.
(3)假若使少量R4+加到Fe(NO3)2溶液中,是否会发生反应?若“否”,说明原因;若“是”,请写出离子方程式:________________________.
(4)R3O4因具有氧化性,被大量用于油漆涂料,涂在钢铁表面,有利于形成耐腐蚀的钝化层.R3O4与足量HNO3反应,生成R的氧化物、R的硝酸盐和水三种物质,此反应的方程式为:________________________________.
(1)R原子的摩尔质量为________.
(2)R元素处于周期表中第________周期________族.
(3)假若使少量R4+加到Fe(NO3)2溶液中,是否会发生反应?若“否”,说明原因;若“是”,请写出离子方程式:________________________.
(4)R3O4因具有氧化性,被大量用于油漆涂料,涂在钢铁表面,有利于形成耐腐蚀的钝化层.R3O4与足量HNO3反应,生成R的氧化物、R的硝酸盐和水三种物质,此反应的方程式为:________________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com