
题目列表(包括答案和解析)
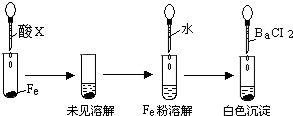 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题: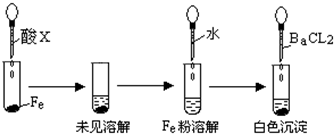
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解.该反应的化学方程式为
_____________________________________________________________________.
(2)某同学未加入其他反应物,而是设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
(3)在一定体积的18 mol/L的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9 mol,则该硫酸的实际体积___________(填“>”“=”或“<”)100 mL。有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?___________(填“可行”或“不可行”).
(4)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,一同学提出溶液呈“绿色”是原因是两份溶液中Cu2+浓度不同造成,你认为该同学的判断 _____ (填 “对” 或 “不对”)
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解.该反应的化学方程式为
_____________________________________________________________________.
(2)某同学未加入其他反应物,而是设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
|
|
(3)在一定体积的18 mol/L的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9 mol,则该硫酸的实际体积___________(填“>”“=”或“<”)100 mL。有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?___________(填“可行”或“不可行”).
(4)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,一同学提出溶液呈“绿色”是原因是两份溶液中Cu2+浓度不同造成,你认为该同学的判断 _____ (填 “对” 或 “不对”)
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解. 该反应的化学方程式为
该反应的化学方程式为
_____________________________________________________________________.
(2)某同学未加入其他反应物,而是设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方 框中画出该装置:
框中画出该装置:
| |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com