
题目列表(包括答案和解析)
氨气作为一种重要的化工原料,主要用于生产氮肥、硝酸、纯碱、尿素等化工产品。下图是合成氨,并联合生产硝酸、纯碱、尿素的简要流程示意图:

反应体系中各组分的部分性质见下表:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210 | -253 | -78 |
| 沸点(℃) | -195 | -259 | -33 |
(1)设备A的名称是 ,副产物B的化学式是
(2)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度至少降低到 ℃(填具体温度),使 分离出来,循环使用的气体有 。
(3)已知尿素的结构简式为![]() 反应②的化学方程式是 。
反应②的化学方程式是 。
|
(5)已知:4NH3+3O2 ![]() 2N2 + 6H2O ,以此设计的氨燃料电池的负极电极反应式为_____________________________(电极材料均为惰性电极,KOH溶液作电解质溶液)。
2N2 + 6H2O ,以此设计的氨燃料电池的负极电极反应式为_____________________________(电极材料均为惰性电极,KOH溶液作电解质溶液)。
氨是一种重要的基础化工原料,可以生产硝酸等一系列化工产品。德国人哈伯在1905年发明的合成氨反应原理为:
![]()
![]() ;
;![]()
回答下列问题:
(1)将10mol ![]() 和30mol
和30mol ![]() 装入密闭容器中,在一定条件下反应达到平衡,若有15%的
装入密闭容器中,在一定条件下反应达到平衡,若有15%的![]() 转化,则反应放出的热量是_______________kJ。
转化,则反应放出的热量是_______________kJ。
(2)工业合成氨生产中采取的措施是____________(填序号)
A. 采用较低压强
B. 采用700K左右的高温
C. 用铁触媒作催化剂
D. 将氨液化及时从混合物中分离,![]() 循环到合成塔中,并补充
循环到合成塔中,并补充![]()
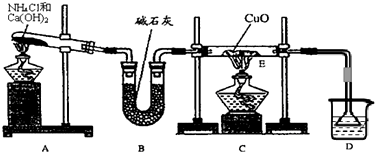
(3)用下图所示装置(夹持固定装置已略去)在实验室中模拟工业制![]()

回答下列问题:
①实验时,A装置中盛放的试剂是__________________________;
装置B中反应的化学方程式为_______________________________________;
②C装置中盛放的试剂是_______________________________________;
该物质的主要作用是_______________________________________;
D装置的作用是_______________________________________;
③若将上图所示装置中虚线部分换成下图所示装置进行实验。反应开始前,分液漏斗中盛放的药品是______________________;烧瓶中盛放的药品是_____________________。

氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质丙和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物M,该物质溶于氢氧化钠溶液。化合物乙是工业制取硝酸的原料之一,乙在催化剂存在下可分解得到H2和另一种单质气体丁。下列说法正确的是( )
A.工业上制备单质丙的方法是电解其氯化物
B.丙丁元素形成化合物可用于制作新型陶瓷
C.甲与水的反应中,水做还原剂
D.单质丙也可以与氢氧化钠反应,并生成白色沉淀物M
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质丙和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物M,该物质溶于氢氧化钠溶液。化合物乙是工业制取硝酸的原料之一,乙在催化剂存在下可分解得到H2和另一种单质气体丁。下列说法正确的是( )
| A.工业上制备单质丙的方法是电解其氯化物 |
| B.丙丁元素形成化合物可用于制作新型陶瓷 |
| C.甲与水的反应中,水做还原剂 |
| D.单质丙也可以与氢氧化钠反应,并生成白色沉淀物M |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com