
题目列表(包括答案和解析)
(16分)工业上可利用煤的气化产物(水煤气)合成二甲醚。
(1)煤的气化的主要化学反应方程式为:_____________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+ CO(g) CH3OH(g) ΔH= -90.8kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) ΔH= -23.5kJ·mol-1
③ CO(g)+ H2O(g) CO2(g)+ H2(g) ΔH= -41.3 kJ·mol-1
总反应:3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g) CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
(16分)工业上可利用煤的气化产物(水煤气)合成二甲醚。
(1)煤的气化的主要化学反应方程式为:_____________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+ CO(g) CH3OH(g) ΔH
= -90.8
kJ·mol-1
CH3OH(g) ΔH
= -90.8
kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) ΔH= -23.5
kJ·mol-1
CH3OCH3(g)+ H2O(g) ΔH= -23.5
kJ·mol-1
③ CO(g)+ H2O(g) CO2(g)+ H2(g) ΔH= -41.3 kJ·mol-1
CO2(g)+ H2(g) ΔH= -41.3 kJ·mol-1
总反应:3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g) CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
工业上可利用煤的气化产物(水煤气)合成二甲醚。
(1)煤的气化的主要化学反应方程式为:_____________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+ CO(g)![]() CH3OH(g) ΔH = -90.8 kJ·mol-1
CH3OH(g) ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ΔH= -41.3 kJ·mol-1
CO2(g)+ H2(g) ΔH= -41.3 kJ·mol-1
总反应:3H2(g)+ 3CO(g)![]() CH3OCH3(g)+ CO2 (g)的ΔH= ___________;
CH3OCH3(g)+ CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)![]() CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
水煤气是重要
燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) ![]() CO (g) +H2 (g) △H= +131.3 kJ•mol-1
CO (g) +H2 (g) △H= +131.3 kJ•mol-1
(1)实际工业生产中,向炭层间隔交替通入水蒸气和空气,其原因是 。
(2)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器编号 | c(H2O)/mol·L-1 | c(CO)/mol·L-1 | c(H2)/mol·L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ________ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正____ν逆 |
(3)生物乙醇可由淀粉或纤维素等生物质原料发酵获得。利用乙醇可进而获得合成气(CO、H2)。
用乙醇生产合成气有如下两条路线:
a、水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b、部分催化氧化:CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)
某生物质能研究所准备利用乙醇得到的合成气合成一种生物汽油。乙醇各分一半按a、b两式反应。合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O。假定合成的生物汽油中含有X、Y两种成分,且X、Y都是有8个碳原子的烃,X是苯的同系物,Y是烷烃。
①X的分子式为 ,Y的分子式为 。
②50吨质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),则最终可获得X的质量为多少吨?
 CH3OH(g);ΔH=-90.8 kJ·mol-1
CH3OH(g);ΔH=-90.8 kJ·mol-1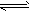 CH3OCH3(g) + H2O(g);ΔH = -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH = -23.5 kJ·mol-1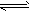 CO2(g) + H2(g);ΔH = -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH = -41.3 kJ·mol-1 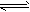 CH3OCH3(g) + CO2(g)的ΔH = ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是_________(填字母序号)。
CH3OCH3(g) + CO2(g)的ΔH = ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是_________(填字母序号)。 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com