
题目列表(包括答案和解析)
某化学探究学习小组拟利用下列装置测定某黑色铁的氧化物矿样的化学式(设矿样不含其它杂质)。主要化学反应为:
①H2C2O4(乙二酸)CO2↑+CO↑+H2O ②Fe![]() O
O![]() +
+![]() CO=
CO=![]() Fe+
Fe+![]() CO2
CO2
他们要测定的数据是矿样质量和反应②所生成的CO2的质量[用m(Fe![]() O
O![]() )和m(CO2)表示]。所需仪器(连同药品)的示意图如下(必要时有的仪器可重复使用)
)和m(CO2)表示]。所需仪器(连同药品)的示意图如下(必要时有的仪器可重复使用)
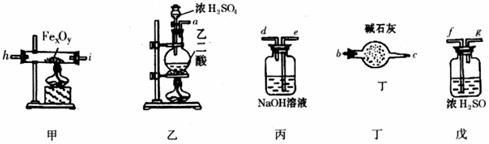
(1)假设洗气(或吸气)装置丙、丁、戊内的反应进行得都完全,按气体从左至右的流向将上述仪器组装起来(用接口字母a、b……表示):
接 , 接 , 接 , 接 , c 接 f
(2)实验中有一件仪器前后用到两次,前边用它的目的是 ,后边又用它的目的是 。
(3)为了保护环境,怎样处理仪器末端导出的CO(写出具体方法)
(4)该小组测得m(Fe![]() O
O![]() )=15.2g,m(CO2)=11.0g,则x:y为
)=15.2g,m(CO2)=11.0g,则x:y为
A.4:5 B.1:1 C.2:3 D.3:4
在该实验中,反应前Fe![]() O
O![]() 为黑色,反应后生成的Fe也为黑色,难以确定Fe
为黑色,反应后生成的Fe也为黑色,难以确定Fe![]() O
O![]() 是否完全被还原,若仍有Fe
是否完全被还原,若仍有Fe![]() O
O![]() 剩余,则所测的x:y值比实际值 (填偏低,偏高或不影响)采取什么措施可以避免上述原因引起的偶然误差:
剩余,则所测的x:y值比实际值 (填偏低,偏高或不影响)采取什么措施可以避免上述原因引起的偶然误差:
(5)仍用上述提供的仪器和药品(必要时可以少选用也可以按新的顺序进行组装),同样测定两种物质的质量,便可计算出x和y的比值,写出要测定的两种数据可能的组合:
① ② ③
(若不够三种组合,可不必填满;若多于三种组合,可自行增加)
实验题
(1)烧碱在保存过程会部分变质(杂质主要为Na2CO3)。
准确称取5.0g样品配制成250mL溶液,各取配制好的烧碱溶液10.00mL于锥形瓶中,分别向锥形瓶中各加入1~2滴酚酞指示剂,(已知:酚酞变色时,此时只有NaOH与HCl反应,Na2CO3还没有与HCl反应)用浓度为0.20mol·L-1的盐酸标准液进行滴定。相关数据记录如下:
|
实验编号 |
V(烧碱溶液)/mL |
V(盐酸)/mL |
|
|
初始读数 |
末尾读数 |
||
|
1 |
10.00 |
0.50 |
21.52 |
|
2 |
10.00 |
1.00 |
21.98 |
|
3 |
10.00 |
0.20 |
24.80 |
试回答:
①滴定时右手的正确操作是______________________________________。
②判断到达滴定终点的实验现象是__________________________________________,依据表中数据,计算出烧碱样品中含NaOH的质量分数为______ _%。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是__________。
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.滴定过程中振荡锥形瓶时,有少量待测溶液溅出
D.滴定前平视读数,滴定结束仰视读数
(2)氧化还原滴定实验同中和滴定类似。过氧化氢是重要的氧化剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度。已知:2KMnO4+5H2O2+6H2SO4===2MnSO4+8H2O+5O2↑,请填写下列空白:
①用 (填“酸式”或“碱式”)滴定管移取过氧化氢溶液25.00 mL至锥形瓶中,作被测试样。
②滴定时,将高锰酸钾标准溶液注入酸式滴定管中,高锰酸钾标准溶液用酸式滴定管原因为 。③重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的物质的量浓度为 。
实验题
(1)烧碱在保存过程会部分变质(杂质主要为Na2CO3)。
准确称取5.0g样品配制成250mL溶液,各取配制好的烧碱溶液10.00mL于锥形瓶中,分别向锥形瓶中各加入1~2滴酚酞指示剂,(已知:酚酞变色时,此时只有NaOH与HCl反应,Na2CO3还没有与HCl反应)用浓度为0.20mol·L-1的盐酸标准液进行滴定。相关数据记录如下:
| 实验编号 | V(烧碱溶液)/mL | V(盐酸)/mL | |
| 初始读数 | 末尾读数 | ||
| 1 | 10.00 | 0.50 | 21.52 |
| 2 | 10.00 | 1.00 | 21.98 |
| 3 | 10.00 | 0.20 | 24.80 |
| 实验编号 | V(烧碱溶液)/mL | V(盐酸)/mL | |
| 初始读数 | 末尾读数 | ||
| 1 | 10.00 | 0.50 | 21.52 |
| 2 | 10.00 | 1.00 | 21.98 |
| 3 | 10.00 | 0.20 | 24.80 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com