
题目列表(包括答案和解析)
A、B、C、D、E五种元素的原子的原子序数都小于18 ,且具有相同的电子层,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序
A. B、A、D、C、E B. C、D、B、A 、E
C.B、A、C、D、E D.C、D、A、B、E
碱存在下,卤代烃与醇反应生成醚(R-O-R');(其中R、R'为烃基)
![]() 化合物A经下列四步反应可得到常用溶剂四氢呋喃,反应框图如下;
化合物A经下列四步反应可得到常用溶剂四氢呋喃,反应框图如下;
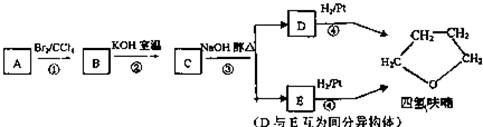
请回答下列问题:
(1)1mol A和1 molH2在一定条件下恰好反应,生成饱和一元醇Y,Y中碳元素的质量分数约为65%,则Y的分子式为 。
A分子中所含官能团的名称是 。
A的结构简式为 。
(2)第①②③步反应类型分为① ② ③
(3)化合物B具有的化学性质(填写字母代号)是 。
a.可发生氧化反应 b.强酸或强碱条件下均可发生消去反应
c.可发生酯反应 d.催化条件下可发生如聚反应
(4)写出C、D和E的结构简式:
C 、D和E 。
(5)写出化合物C与NaOH水溶液反应的化学方程式;
(6)写出四氢呋喃链状醚类的所有同分异构体的简式;

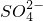 浓度的变化情况为______(填序号)
浓度的变化情况为______(填序号)若进行下列演示实验:a.制甲烷、b.制乙烯、c.石蜡催化裂化、d.石油的分馏、e.制溴苯、f.制酚醛树脂、g.制乙酸乙酯、h.制硝基苯等,需要冷凝装置的实验组是( )
A.c、d、e B.c、d、e、h
C.c、d、e、f、g、h D.a~h全部需要
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com