
题目列表(包括答案和解析)
| A.①、② | B.②、④ | C.②、③ | D.③、④ |
碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为 ?????????????????????????????????????????????????????????????????? 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s)??? ? △H=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)? △H=+116.5 kJ·mol-1
③H2O(1)=H2O(g)? ??????????????????? △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式?????????????????
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为??????????????? ;每消耗3.4g NH3转移的电子数为??????????????? (阿伏加德罗常数的值用NA表示)。
(4)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g)? △H=Q kJ·mol-1。
N2(g)+CO2(g)? △H=Q kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
???????? 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= ????? ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是? ?? ? (填字母编号)。
a.加入一定量的活性炭 ???? b.通人一定量的NO
c.适当缩小容器的体积?????? d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q ??? 0(填“>”或“<”)。?
下图是工业生产硝酸铵的流程。
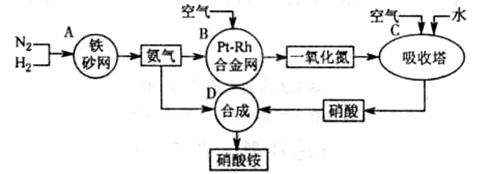
(1)吸收塔C中通入空气的目的是 。A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) +6H2O(g) △H =-1266.8kJ/mol
N2(g) + O2(g) = 2NO(g) △H = +180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: 。
(3)已知:N2(g) +3H2(g) ![]() 2NH3(g) △H=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有 (填字母)。
2NH3(g) △H=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有 (填字母)。
A.升高温度 B.使用催化剂 C.增大压强 D.循环利用和不断补充氮气
(4)在一定温度和压强下,将H2和N2按3 : 1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,求此时H2的转化率?(要有完整的计算过程,结果保留三位有效数字)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com