
题目列表(包括答案和解析)
在标准状况下进行甲、乙、丙三组实验:三组各取30毫升同浓度的盐酸溶液,加入同一种镁铝合金粉未,产生气体,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量(毫克) | 255 | 385 | 459 |
生成气体体积(毫升) | 280 | 336 | 336 |
(16分)钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是 (用离子方程式表示)。
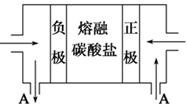
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:
正极的电极反应式为 ,电池工作时物质A可循环使用,A物质的化学式为 。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
实验序号 | Ⅰ | Ⅱ | Ⅲ |
稀硫酸体积(mL) | 100 | 100 | 100 |
混合物质量(g) | 2.22 | 11.1 | 33.3 |
产生气体体积(L) | 2.24 | 11.2 | 11.2 |
(1)实验中,硫酸过量的实验为________。(填序号)
(2)稀硫酸的物质的量浓度为________。
(3)固体粉末中Mg和Al的物质的量之比为________。
(4)当稀硫酸体积为350mL时,加入33.3 g该固体粉末,充分反应后产生的气体体积(折算成标准状况)为_______________L。
钙在加热时能与氮气、氢气反应。氢化钙遇水立即反应生成氢氧化钙和氢气,氢化钙通常用氢气与金属钙加热制取,图1是横拟制取装置。

(1)用浓硫酸配制l:4(体积比)的稀硫酸,需用的玻璃仪器是烧杯、________。
(2)装置D中竖直导管的作用是________________________。
(3)为了确认进入装置C的氢气已经干燥,可在B、C之间再接一装置,该装置中加入的试剂是_______。加热C装置前要对H2验纯,方法是:收集一试管气体,将管口靠近酒精灯火焰,若听到“噗噗”的声音,说明H2__________________________。
(4)甲同学认为只要装置合理、操作规范就可以排除生成__________(选填序号)。
a.Ca3N2 b.CaO c.Ca(OH)2
(5)乙同学用上图装置测定制得的氢化钙的纯度。他称取46 mg样品,与足量水反应,恒温时,注射器量出产生的气体为48.06 mL(已换算为标准状况)。产生实验误差的原因可能是_______(选填编号)。
①H2通入不足,反应器中有空气
②钙与H2未充分反应
③产物与空气接触
(6)丙同学根据乙同学的实验数据列了一个关系式,42x+40y=0.046、2x+y=48.06/22400请指出式子中y的含义___________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com