
题目列表(包括答案和解析)
含Cr2O72-的酸性工亚废水会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转变为Cr(OH)3除去。工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓人空气。结果溶液的pH不断升高,溶液由酸性转为碱性。在以上处理过程中,溶液pH升高的原因是( )
A. 电解时废水体积减小
B. 鼓人空气使溶液中OH-浓度增大
C. 电解时H+在阴极被还原
D. Cr2O72-被还原为Cr3+时消耗了H+
A. 电解时废水体积减小
B. 鼓人空气使溶液中OH-浓度增大
C. 电解时H+在阴极被还原
D. Cr2O72-被还原为Cr3+时消耗了H+
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
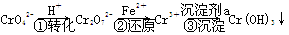
其中第①步中存在平衡:2CrO42- (黄色)+2H+??Cr2O72- (橙色)+H2O。下列有关说法正确的是( )
A.第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态
B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成
C.第②步中,还原0.1 mol Cr2O72-需要45.6 g FeSO4
D.第③步沉淀剂a可以使用NaOH等碱性物质

| A.第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态 |
| B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 |
| C.第②步中,还原0.1 mol Cr2O72-需要45.6 g FeSO4 |
| D.第③步沉淀剂a可以使用NaOH等碱性物质 |
| A.Ba(NO3)2 | B.BaCl2 | C.Ba(OH)2 | D.溶有NH3的BaCl2溶液 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com