
题目列表(包括答案和解析)
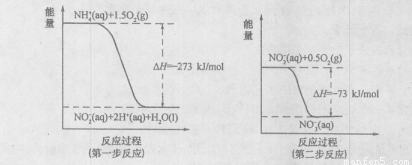
(I)某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如下:
 [来源:学,科,网]
[来源:学,科,网]
(1)1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是 。
(2)在一定条件下,向废水中加入CH3OH,将HNO3还原成N2,若该反应消耗32gCH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
(Ⅱ)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO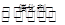 2CO2+N2
△H
2CO2+N2
△H
某温度下用气体传感器测得不同的时间的NO和CO浓度如下表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
C(NO)(×10-4mol·L-1) |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
|
C(CO)(×10-3mol·L-1) |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)
(2)前2s内的平均反应速率v(N2)= ;
(3)在该温度下,反应的平衡常数K= (只写出计算结果);
(4)某同学设计了三组实验,分别验证温度、催化剂比表面积对化学反应速率的影响规律,部分实验条件如下表:
|
实验编号 |
T/℃ |
NO初始浓度/mol·L-1 |
CO初始浓度/mol·L-1 |
催化剂的比表面积/m2·g-1 |
|
I |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
II |
280 |
1.20×10-3 |
5.80×10-3 |
124 |
|
III |
350 |
1.20×10-3[来源:学.科.网] |
5.80×10-3 |
124 |
该同学画出了表中三个实验条件下,混合气体中NO浓度随时间变化的趋势曲线图,请在图上标明各条曲线的实验编号;
(5)有人认为:催化剂比表面积增大,会提高NO和CO的反应效率,从而使污染物NO和CO的转化率提高。请用化学基本理论对此观点进行评价: 。
(I)某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如下:
(1)1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是 。
(2)在一定条件下,向废水中加入CH3OH,将HNO3还原成N2,若该反应消耗32gCH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
(Ⅱ)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO![]() 2CO2+N2 △H
2CO2+N2 △H
某温度下用气体传感器测得不同的时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)(×10-4mol·L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)(×10-3mol·L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)
(2)前2s内的平均反应速率v(N2)= ;
(3)在该温度下,反应的平衡常数K= (只写出计算结果);
(4)某同学设计了三组实验,分别验证温度、催化剂比表面积对化学反应速率的影响规律,部分实验条件如下表:
| 实验编号 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 催化剂的比表面积/m2·g-1 |
| I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| II | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| III | 350 | 1.20×10-3[来源:学.科.网] | 5.80×10-3 | 124 |
该同学画出了表中三个实验条件下,混合气体中NO浓度随时间变化的趋势曲线图,请在图上标明各条曲线的实验编号;
(5)有人认为:催化剂比表面积增大,会提高NO和CO的反应效率,从而使污染物NO和CO的转化率提高。请用化学基本理论对此观点进行评价: 。
(15分)
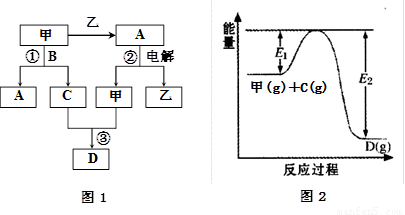
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有 (填字母)。
a.置换反应 b.复分解反应 c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是 。(3分)
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00 mol甲和2.00 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为
mol•L-1•min-1。
(5)容积均为2 L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
| 容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
①若方程式系数为最简整数比,则该温度下的平衡常数K=
填写表中空格: ② ③
(15分)
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有 (填字母)。
a.置换反应 b.复分解反应 c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是 。(3分)
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00 mol甲和2.00 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为
mol•L-1•min-1。
(5)容积均为2 L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
|
容器编号 |
n(甲) |
n(C) |
n (D) |
v正与v逆的关系 |
|
Ⅰ |
0.20 |
0.10 |
0.20 |
v正=v逆 |
|
Ⅱ |
0.20 |
0.40 |
1.00 |
②? |
|
Ⅲ |
0.60 |
1.20 |
0.80 |
③? |
①若方程式系数为最简整数比,则该温度下的平衡常数K=
填写表中空格: ② ③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com