
题目列表(包括答案和解析)
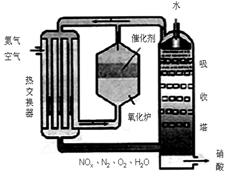
下图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
①4NH3(g)+5O2(g)4NO(g)+6H2O(l) △H<0
②2NO(g)+O2(g)2NO2(g) △H<0
③3NO2(g)+H2O(l)2HNO3(l) +NO(g) △H<0
(1)能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 。
A.适当升高温度 B.适当增大吸收塔内的压强
C.增大空气中O2的浓度 D.吸收塔内填充瓷环,增大气液接触面
(2)在2L密闭容器内充入0.50mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= 。
(3)某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 。
②每小时从吸收塔淋下的水的质量应是多少吨?
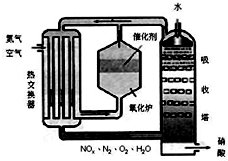
下图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
①4NH3(g)+5O2(g) 4NO(g)+6H2O(l) △H<0
4NO(g)+6H2O(l) △H<0
②2NO(g)+O2(g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
(1)能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 。
| A.适当升高温度 | B.适当增大吸收塔内的压强 |
| C.增大空气中O2的浓度 | D.吸收塔内填充瓷环,增大气液接触面 |
下图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
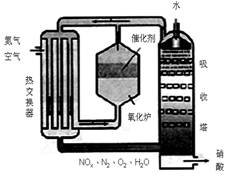
①4NH3(g)+5O2(g) 4NO(g)+6H2O(l) △H<0
4NO(g)+6H2O(l) △H<0
②2NO(g)+O2
(g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
(1)能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 。
A.适当升高温度 B.适当增大吸收塔内的压强
C.增大空气中O2的浓度 D.吸收塔内填充瓷环,增大气液接触面
(2)在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= 。
(3)某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 。
②每小时从吸收塔淋下的水的质量应是多少吨?
 下图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
下图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:下图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(l) △H<0
4NO(g)+6H2O(l) △H<0
②2NO(g)+O2 (g)![]() 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l)![]() 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
(1)能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 。
A.适当升高温度 B.适当增大吸收塔内的压强
C.增大空气中O2的浓度 D.吸收塔内填充瓷环,增大气液接触面
(2)在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= 。
(3)某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 。
②每小时从吸收塔淋下的水的质量应是多少吨?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com