
题目列表(包括答案和解析)
如下图所示两个装置中,溶液体积均为200 mL,开始时电解质溶液的浓度均为
0.1mol·L-1,工作一段时间后,测得导线上通过0.02 mol电子,若不考虑盐
水解和溶液体积的变化,则下列叙述正确的是
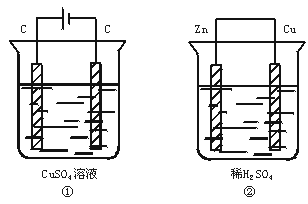
A.产生气体的体积:①>②
B.电极上析出固体的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:①阳极:4OH--4e-===2H2O+O2↑
②阴极:2H++2e-===H2↑
如下图所示两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol·L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是
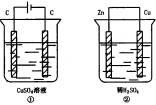
( )
A. 产生气体的体积:①>②
B. 电极上析出固体的质量:①>②
C. 溶液的PH变化:①增大,②减小
D. 电极反应式:①阳极:40H--4e—![]() 2H2O+O2②阴极:2H++2e—
2H2O+O2②阴极:2H++2e—![]() H2↑
H2↑

( )
A. 产生气体的体积:①>②
B. 电极上析出固体的质量:①>②
C. 溶液的PH变化:①增大,②减小
D. 电极反应式:①阳极:40H--4e—![]() 2H2O+O2②阴极:2H++2e—
2H2O+O2②阴极:2H++2e—![]() H2↑
H2↑
在如图所示两个装置中,溶液体积均为200mL,开始时电解质溶液浓度均为0.11mol/L,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐类的水解和溶液体积的变化,试求:
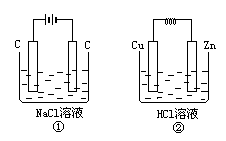
(1)两装置产生的气体在标准状况下所占体积各为多少升?
(2)两装置中反应后的pH各为多少?
如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定)。

|
实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
|
1 |
40 mL HCl |
40 mL NH3 |
产生白烟 |
|
2 |
40 mL Cl2 |
10mL 水 |
剩余气体为20mL |
|
3 |
30 mL NO |
15 mL O2 |
|
|
4 |
20 mL AlCl3溶液 |
10 mL NaOH溶液 |
生成白色沉淀,后消失 |
(1)如果实验1甲针筒内改装30 mL Cl2 ,乙针筒内仍为40 mL NH3,实验时,甲针筒内也有白烟产生。写出有关反应的化学方程式 。
(2)由实验2可知,常温常压下氯气在水中的溶解度为 。
(3)实验3 反应后甲针筒内气体的体积为 。
(4)实验4中,AlCl3溶液浓度为0.1mol/L,如果最后白色沉淀全部消失,则NaOH溶液浓度至少为 mol/L。
(5)将上述装置做以下改进:在甲、乙针筒之间连接一段硬质玻璃管,如下图。在A处装一种浅黄色的粉末,乙针筒内是一种常见的气体,甲针筒无气体。将乙针筒内气体压入甲针筒内,发现气体体积是原来的一半。A处的物质是 ,甲针筒内的气体为 。

(6)有学生用上述改进后的装置测定空气中氧气的体积分数(加热用酒精灯未画出)。乙针筒内装有50 mL空气。实验时,用酒精灯对A处物质进行加热,经反复慢慢推拉两针筒的活塞,反应完毕,恢复至室温,测得剩余气体为40.5mL。
①A处的物质是 (选填编号)。
a.碳粉 b.二氧化锰 c.铜粉 d.氧化铜
②已知空气中氧气的体积分数为0.2,则该实验的相对误差为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com