
题目列表(包括答案和解析)
 科研小组为探究氮的化合物性质,按如图连接好装置,进行实验.将C处Pt丝加热至红热,再将A试管中物质加热,片刻撤去C处酒精灯.部分实验现象有:①Pt丝继续保持红热,②E中Cu片慢慢溶解.回答下列问题:
科研小组为探究氮的化合物性质,按如图连接好装置,进行实验.将C处Pt丝加热至红热,再将A试管中物质加热,片刻撤去C处酒精灯.部分实验现象有:①Pt丝继续保持红热,②E中Cu片慢慢溶解.回答下列问题:
| ||
| △ |
| ||
| △ |
 硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示:
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示: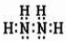
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com