
题目列表(包括答案和解析)
下列叙述正确的是 ( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)=H2O(l) DH=-a kJ·mol-1
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
下列叙述正确的是 ( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)=H2O(l) DH=-a kJ·mol-1
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
下列叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:
OH-(aq)+H+(aq)=H2O(l) ∆H = -a kJ·mol-1
C.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
D.对于2HI(g)  H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
下列叙述正确的是 ( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)=H2O(l) H = -a kJ·mol-1
C.电解精炼铜时,同一时间内阳极溶解铜的质量可能比阴极析出铜的质量小
D.对于2HI(g)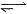 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
| A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为: OH-(aq)+H+(aq)=H2O(l) ?H =" -a" kJ·mol-1 |
| C.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
D.对于2HI(g)  H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com