
题目列表(包括答案和解析)
氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) ![]() CO2(g)+ H2(g); △H<0。在850℃时,K=1。
CO2(g)+ H2(g); △H<0。在850℃时,K=1。
??????(1)若升高温度到950℃时,达到平衡时K ▲ 1(填“大于”、“小于”或“等于”)
??????(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、
1.0mol CO2 和 x mol H2,则:
①当x=5.0时,上述平衡向 ▲ (填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 ▲ 。
??????(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a ▲ b(填“大于”、“小于”或“等于”)。
氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) CO2(g)+ H2(g); △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K ▲ 1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、
1.0mol CO2 和 x mol H2,则:
①当x=5.0时,上述平衡向 ▲ (填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 ▲ 。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a ▲ b(填“大于”、“小于”或“等于”)。
氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) 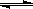 CO2(g)+ H2(g); △H<0。在850℃时,K=1。
CO2(g)+ H2(g); △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K ▲ 1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、
1.0mol CO2 和 x mol H2,则:
①当x=5.0时,上述平衡向 ▲ (填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 ▲ 。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a ▲ b(填“大于”、“小于”或“等于”)。
硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。
(1)将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。溶液由棕黄色变为浅绿色用离子方程式表示为_____,后又由浅绿色变为棕黄色的离子方程式为_____。
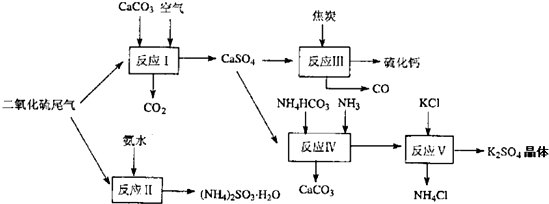
(2)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCI为原料可以合成有重要用途的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
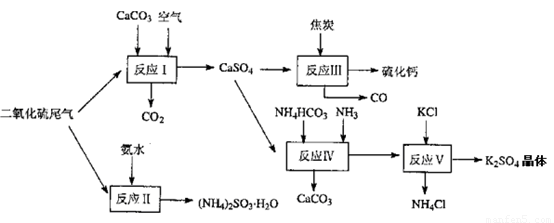
写出反应反应Ⅳ的化学方程式 ;
反应III中氧化剂与还原剂的物质的量之比为__ __;
反应V在25'C、40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是 。
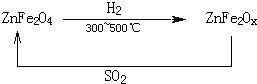
(3)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下能使SO2分解,减小工业废气对环境的影响,它由铁酸锌(ZnFe2O4)经高温还原制得,转化流程如下图所示:

若2molZnFe2Ox与SO2反应可生成 0.75molS,x= ,写出铁酸锌高温下被还原生成氧缺位铁酸锌的化学方程式
(4)石灰石-石膏湿法烟气脱硫工艺技术的原理是烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4.2H2O),写出该反应的化学方程式 。某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则可生产石膏 t。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com