
题目列表(包括答案和解析)
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 NH3H2O+H+
NH3H2O+H+ NH3H2O+H+
NH3H2O+H+
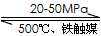 2NH3(g) △H=-192.0kJ·mol-1
2NH3(g) △H=-192.0kJ·mol-1 
 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________。 科学家一直致力研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3,反应的化学方程式如下:N2(g)+ 3H2O(l) ![]() 2NH3(g)+ O2(g)。回答下列问题:
2NH3(g)+ O2(g)。回答下列问题:
(1)进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h),则该反应的正反应为 反应(填“吸热”或“放热”)
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(3)合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数
据如下:
H2(g) :△H =-285.8 kJ・mol-1;
CO(g) : △H =-283.0 kJ・mol-1;
CH4(g) :△H =-890.3 kJ・mol-1 。
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式__________________________________。
(4)有人设想寻求适合的催化剂和电极材料,以N2、H2为电极反应物,以HCl——NH4Cl为电解质溶液制成新型燃料电池,请写出该电极的正极反应式
(5)生成的NH3可用于制铵态氮肥,如(NH4)2SO4、NH4Cl,这些肥料显 性,原因是(用离子方程式表示)___________________________,使用时避免与________________物质合施。
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
| 4 |
| 7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com