
题目列表(包括答案和解析)
⑴事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是____________________________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
⑵以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为_______________。
⑶电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中a为电解液,X和Y均为惰性电极,则: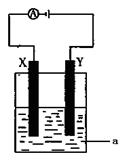
①若a为CuSO4溶液,则电解时的化学反应方程式为____________________________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。
⑴事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是____________________________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
⑵以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为_______________。
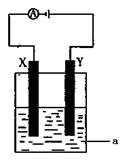
⑶电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:

①若a为CuSO4溶液,则电解时的化学反应方程式为____________________________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。
|
事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 | |
| [ ] | |
A. |
C(s)+H2O(g)=CO(g)+H2(g) ΔH>0 |
B. |
2H2(g)+O2(g)=2H2O(l) ΔH<0 |
C. |
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0 |
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是________.(填字母)
A.C(s)+H2O(g)=CO(g)+H2(g) ΔH>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) ΔH<0
C.2CO(g)+O2(g)=2CO2(1) ΔH<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为________.
(3)利用下图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于________处,此时溶液中的阴离子向极(填X或铁)移动.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com