
题目列表(包括答案和解析)
下图所示为制取氯气的实验装置:
烧瓶中盛放的固体是MnO2,请回答下列问题:
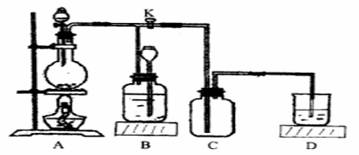
(1)盛放药品前,怎样检验此装置的气密性_________________
(2)分液漏斗中盛放的液体是___________,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为___________________
(3)D中盛放的液体是_______;其作用为________
(4)B中盛放的液体是__________;收集氯气完毕,所进行的操作为__________.B装置的作用是________.
(5)欲收集到干燥纯净的氯气应对此装置进行一些改进.试画出改进的装置图,并标出装置中所盛放的药品:

 某学生设计如图所示实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应,反应后温度将升高),A中盛浓盐酸,C中盛潮湿的消石灰,据此回答下列问题:
某学生设计如图所示实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应,反应后温度将升高),A中盛浓盐酸,C中盛潮湿的消石灰,据此回答下列问题:
| ||
| ||
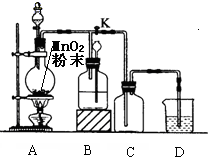 为制取多瓶氯气,采用如图所示的实验装置,烧瓶中盛放的固体是二氧化锰.请回答下列问题:
为制取多瓶氯气,采用如图所示的实验装置,烧瓶中盛放的固体是二氧化锰.请回答下列问题: 某学生设计如图所示实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应,反应后温度将升高),A中盛浓盐酸,C中盛潮湿的消石灰,据此回答下列问题:
某学生设计如图所示实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应,反应后温度将升高),A中盛浓盐酸,C中盛潮湿的消石灰,据此回答下列问题: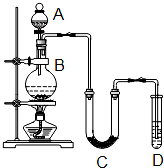
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com