
题目列表(包括答案和解析)
| A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构 |
| B.1 mol金刚石晶体中,平均含有2 mol C-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
D.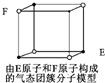 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
下列说法错误的是 ( )
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
 B.1mol金刚石晶体中,平均含有2mol C—C键
B.1mol金刚石晶体中,平均含有2mol C—C键
C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S
分子间不能形成氢键
D.某气态团簇分子结构如右图所示,该气态团簇分子的分子
式为EF或FE
下列说法错误的是( )
| A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构 |
| B.1 mol金刚石晶体中,平均含有2 mol C—C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如右图所示,该气态团簇分子的分子式为EF或FE |
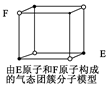
下列说法错误的是( )
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B.1 mol金刚石晶体中,平均含有2 mol C—C键
C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键
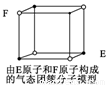
D.某气态团簇分子结构如右图所示,该气态团簇分子的分子式为EF或FE
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com