
已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)25°C时,水的电离平衡曲线应为哪一条?请说明理由
A 水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小
A 水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小
(2)95°C时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为为多少?
(3)95°C时,若10体积pH
1=a的某强酸溶液与1体积pH
2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH
1与强碱的pH
2之间应满足的关系是?
(4)曲线B对应的温度下,pH=2的某酸HA与pH=10的NaOH溶液等体积混合后,溶液的pH=5,请分析其原因
曲线B对应95℃,此时水的离子积为10-12,HA若为强酸,最后应为pH=6,现pH=5,说明HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+
曲线B对应95℃,此时水的离子积为10-12,HA若为强酸,最后应为pH=6,现pH=5,说明HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+
.

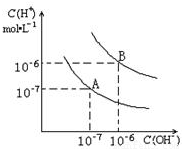
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: (2011?烟台模拟)水的电离平衡曲线如图所示:
(2011?烟台模拟)水的电离平衡曲线如图所示: