
题目列表(包括答案和解析)
在制硫酸的工业中有以下反应:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH<O,下列说法错误的是( )
2SO3(g) ΔH<O,下列说法错误的是( )
A.生产中通入过量的空气,可以提高二氧化硫的转化率
B.生产中选择400—500 ℃,不仅能加快反应速率而且催化剂的活性好
C.根据实际情况在生产中选择常压,可以提高综合经济效益
D.在接触室被氧化生成的三氧化硫,进入吸收塔被水吸收制成硫酸
用下图装置模拟人工肾脏的工作原理,电解生成的Cl2将尿素[CO(NH2)2]氧化成N2排出,则下列说法错误的是
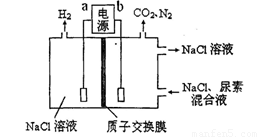
A.电源的正极为b
B.尿素被氧化的化学方程式为CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
C.电解结束后,阴极室溶液与电解前相比pH增大
D.阳极收集到气体4.48 L(标准状况)时,被氧化的尿素为6.0 g
2SO2(g)+O2(g)![]() 2SO3(g) ΔH<O,下列说法错误的是( )
2SO3(g) ΔH<O,下列说法错误的是( )
A.生产中通入过量的空气,可以提高二氧化硫的转化率
B.生产中选择400—
C.根据实际情况在生产中选择常压,可以提高综合经济效益
D.在接触室被氧化生成的三氧化硫,进入吸收塔被水吸收制成硫酸
 在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2 | O2 | SO3 | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 1 | Q2= 39.4 |
X2 |
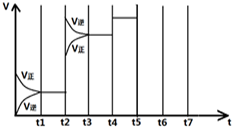
| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
在恒容密闭容器中存在下列平衡:C(s)+H2O(g) CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如右图所示。下列说法错误的是
CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如右图所示。下列说法错误的是

A.该反应的ΔH>0
B.若T1、T2时的平衡常数分别为K1、K2,则K1=K2
C.通过加热可以使B点变到C点
D.在T2时若反应进行到状态D,则一定有υ(正) <υ(逆)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com