
题目列表(包括答案和解析)
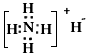
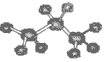
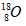
下列化学用语使用正确的是 ( )
A.NH4H的电子式: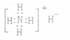 B.丙烷分子的球棍模型:
B.丙烷分子的球棍模型:
C.次氯酸的结构式:H—Cl—O D.甲醇的分子式:CH3OH
A.NH4H的电子式: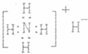 |
B.丙烷分子的球棍模型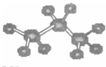 |
| C.次氯酸的结构式:H-Cl-O |
| D.原子核内有10个中子的氧离子:818O |


下列化学用语使用正确的是 ( )
A.NH4H的电子式:![]() B.丙烷分子的球棍模型:
B.丙烷分子的球棍模型:![]()
C.次氯酸的结构式:H—Cl—O D.甲醇的分子式:CH3OH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com