通过金属与盐溶液的置换反应可以比较金属还原性的强弱,通过非金属间的置换反应,也可以比较非金属氧化性的强弱.
实验一:说明氯的氧化性强于碘.
Ⅰ.向盛有KI溶液的试管中加入少许CCl
4后,滴加新制氯水,振荡,CCl
4层变成紫色.
用离子方程式表示CCl
4层变紫色的原因
2I-+Cl2=I2+2Cl-
2I-+Cl2=I2+2Cl-
Ⅱ.如果继续向试管中滴加氯水,振荡,CCl
4层会逐渐变浅,最后变成无色.
CCl
4层最后变成无色的原理如下,完成并配平该反应:
5
5
Cl2
Cl2
+
1
1
I
2+
6
6
H2O
H2O
→
2
2
HIO
3+
10
10
HCl
HCl
Ⅲ.氯的非金属性比碘强,用原子结构解释原因:
同主族元素从上到下原子核外电子层数依次增多
同主族元素从上到下原子核外电子层数依次增多
,
原子半径逐渐增大,得电子能力逐渐减弱.
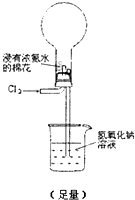
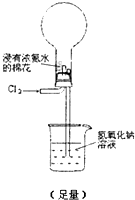
实验二:说明氯元素的氧化性强于氮元素
下面装置(烧瓶内已无空气)能实现Cl
2置换N
2的反应,请回答:
通入 Cl
2 后:
Ⅰ.现象一:烧瓶中会出现白烟.白烟的成分是
NH4Cl
NH4Cl
.
Ⅱ.现象二:形成喷泉,NaOH溶液进入烧瓶.烧瓶内压强减小的原因是
烧瓶内发生反应8NH3(g)+3Cl2(g)=N2(g)+6NH4Cl(s),气体大量减少,烧瓶内压强低于大气压
烧瓶内发生反应8NH3(g)+3Cl2(g)=N2(g)+6NH4Cl(s),气体大量减少,烧瓶内压强低于大气压
. 写出NaOH在烧瓶内发生反应的离子方程式
NH4++OH-?NH3?H2O,Cl2+2OH-=Cl-+ClO-+H2O
NH4++OH-?NH3?H2O,Cl2+2OH-=Cl-+ClO-+H2O
Ⅲ.除上述现象外,能说明有N
2产生的实验现象是
液体不能充满烧瓶
液体不能充满烧瓶
.

 +___
+___ +__
+__ →___HIO3+___
→___HIO3+___
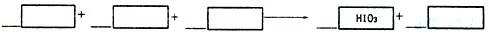
 通过金属与盐溶液的置换反应可以比较金属还原性的强弱,通过非金属间的置换反应,也可以比较非金属氧化性的强弱.
通过金属与盐溶液的置换反应可以比较金属还原性的强弱,通过非金属间的置换反应,也可以比较非金属氧化性的强弱.