
题目列表(包括答案和解析)
(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中液体的体积是___________________mL。(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)______________。

A.是amL
B.是(50-a)mL
C.一定大于amL
D.一定大于(50-a)mL
(I)化学是一门以实验为基础的学科,下列实验操作的描述中,正确的是________________(填序号)。
① 为使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜丝网包裹的锌粒
② 酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏高
③ 配制一定物质的量浓度的溶液时,容量瓶洗涤后未进行干燥
④ 以酚酞作指示剂,用标准浓度的盐酸滴定NaOH溶液,待溶液变成浅红色时即停止滴定
⑤ 测定溶液的pH时,用洁净、干燥的玻璃棒蘸取待测溶液,点在试纸中部,待变色后与标准比色卡对照读数
⑥滴定终点时,若不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量进行调整
 (II)填空
(II)填空
(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中液体的体积是______。
(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) 。
A.是amL B.是(50—a)mL C.—定大于amL D.一定大于(50—a)mL
如图
(1)图I表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL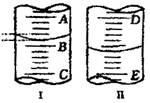 ,如果刻度A为4,量筒中液体体积是 mL。
,如果刻度A为4,量筒中液体体积是 mL。
(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) 。
A.是a mL B.是(50-a)mL
C.一定大于a mL D.一定大于(50-a)mL
 草酸晶体的组成可用H2C2O4?xH2O表示,为了测定x值,进行如下实验:
草酸晶体的组成可用H2C2O4?xH2O表示,为了测定x值,进行如下实验:| V |
| 10 |
| V |
| 10 |
(11分)草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
称取Wg草酸晶体,配成100.00mL无色水溶液。量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定。试回答:
(1)滴定时所发生反应的化学方程式为
(2)草酸是二元弱酸,则草酸的电离方程式为 请从“电离平衡”的角度解释:为什么草酸的第二步电离比第一步难
图I表示100mL量筒中液面的位置,A与B,B与C刻度间相差10mL,如果刻度A为30,量筒中液体的体积是___________mL。图II表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_____________。
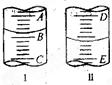
A.是amL B.是(25-a)mL
C.一定大于amL D.一定大于(25-a)mL
(3)实验中,标准液KMnO4溶液应装在_______式滴定管中。若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会_____(偏大、偏小、无影响)达到滴定终点,溶液由 色变为 色;
(4)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为_______mol·L-1;
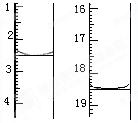
(5)若测得x=2,称取某二水合草酸晶体0.1200 g,加适量水完全溶解,然后用0.02000 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com