电镀含铬废水的处理方法较多.
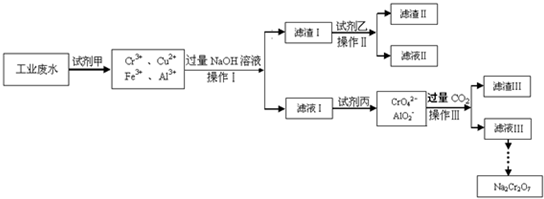
Ⅰ.某工业废水中主要含有Cr
3+,同时还含有少量的Cu
2+、Fe
2+、Fe
3+和Al
3+等,且酸性较强.为回收利用,通常采用如下流程处理:
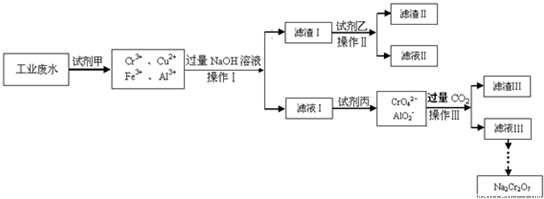
已知:
(1)Cr(OH)
3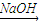
NaCrO
2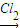
Na
2CrO
4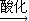
Na
2Cr
2O
7(2)Cu(OH)
2能溶于氨水:Cu(OH)
2+4NH
3?H
2O=[Cu(NH
3)
4]
2++2OH
-+4H
2O
请回答:(1)操作Ⅰ的名称______,上述操作Ⅰ、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有______.
(2)滤渣Ⅰ的主要成分为______(写化学式),试剂乙的名称______.
(3)加入试剂甲的目的______.
(4)废水处理流程中生成滤渣Ⅲ的离子方程式
:______.
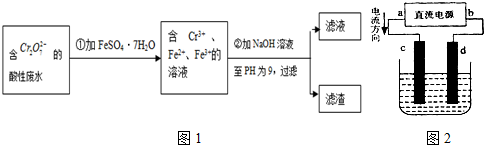
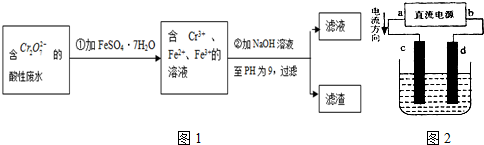
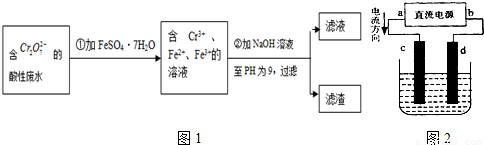
Ⅱ.酸性条件下,六价铬主要以Cr
2O
72-形式存在.工业上用以下方法处理处理含Cr
2O
72-的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)
3和Fe(OH)
3沉淀产生;③过滤回收沉淀,废水达到排放标准.
(5)电解时能否用Cu电极来代替Fe电极?______(填“能”或“不能”),理由是______.
(6)已知某含Cr
2O
72-的酸性工业废水中铬元素的含量为104.5mg/L,处理后铬元素最高允许排放浓度为0.5mg/L.处理该废水1000m
3并达到排放标准,至少消耗铁的质量为______kg.

 NaCrO2
NaCrO2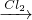 Na2CrO4
Na2CrO4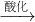 Na2Cr2O7
Na2Cr2O7
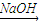 NaCrO2
NaCrO2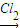 Na2CrO4
Na2CrO4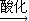 Na2Cr2O7
Na2Cr2O7