
题目列表(包括答案和解析)
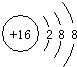
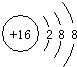
微粒代码 | a | b | c | d | e | f | g | h |
原子核个数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
带电荷数(单位:电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 | +1 |
其中b的离子半径大于e的离子半径,d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子,d微粒和h微粒在一定条件下可互相转化,试写出:?
(1)a微粒原子核外结构示意图: ,c微粒电子式为 。?
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为: > (写化学式)?
(3)c微粒和f微粒反应生成2分子g的离子方程式为 。?
(4)大量c微粒和大量h微粒共热生成d微粒的离子反应方程式为 。?
(5)大量微粒g所构成的晶体属 ;d微粒分子结构呈 ;h微粒所构成的晶体中化学键的类型有 。
微粒代号 | a | b | c | d | e | f | g | h |
原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
微粒所带电荷数 | 0 | +1 | -1 | 0 | +2 | +1 | 0 | +1 |
其中b的离子半径大于e的离子半径,d是由极性键构成的四原子分子,c与f可形成两个共价型g分子,h和c作用可形成d和g两种分子。试写出:
(1)a微粒的电子式_________。
(2)b与e相应元素的最高价氧化物的水化物的碱性比较为___________>__________。(用化学式表示)
(3)用电子式表示g微粒的形成过程:_______________________________________________。
(4)h和c作用可形成d和g的离子方程式:__________________________________________。
(5)写出b元素的最高价氧化物的水化物的电子式:___________________________________。
(6)c微粒是___________,f微粒是_____________。(写化学式)
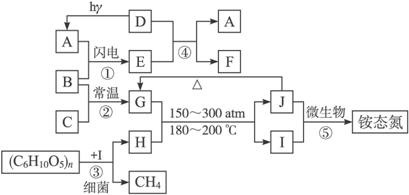
图4-1
请回答下列问题:
(1)C的名称是___________;反应①②共同的化学、生物学意义是什么?
(2)与反应④有关的环境公害是什么?分析其中D所起的作用。__________________________________________________________________
(3)与物质H有关的环境公害是什么?美国目前是世界上造成这种环境公害最严重的国家;你认为美国政府未能解决导致这种公害的两大主要问题是什么?__________________________________________________________________
(4)写出反应⑤的离子方程式,并指出该化学反应的意义。__________________________________________________________________
(5)1997年美国三位科学家因发现物质D具有多种生理学功能而荣获诺贝尔生理学或医学奖。请问:
①物质D是___________系统中传递信号的分子,在体内可松驰___________,有助于调节___________;
②治疗心绞痛的药物硝化甘油之所以具有___________的生理作用,是由于硝化甘油在人体体液中的酶作用下缓慢氧化自发释放出D分子,同时生成CO2、H2O,写出该氧化还原反应方程式。______________________。
a、b、c、d、e、f、g、h为8种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c | d | e | f | g | h |
| 原子核个数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
| 带电荷数(单位:电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 | +1 |
其中b的离子半径大于e的离子半径,d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子,d微粒和h微粒在一定条件下可互相转化,试写出:?
(1)a微粒原子核外结构示意图: ,c微粒电子式为 。?
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为: > (写化学式)?
(3)c微粒和f微粒反应生成2分子g的离子方程式为 。?
(4)大量c微粒和大量h微粒共热生成d微粒的离子反应方程式为 。?
(5)大量微粒g所构成的晶体属 ;d微粒分子结构呈 ;h微粒所构成的晶体中化学键的类型有 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com