
题目列表(包括答案和解析)
| A、Al3+ | B、Na+ | C、I- | D、CO32- |
下列溶液中,氯离子的浓度与50mL 1 mol·L-1的氯化铝溶液中氯离子的浓度相等的是( )
A.150 mL 1 mol·L-1的NaCl溶液?
B.75 mL 2 mol·L-1的氯化铵溶液?
C.150 mL 1 mol·L-1的KCl溶液?
D.75 mL 1.5 mol·L-1的氯化镁溶液?
A.150 mL 1 mol·L-1的NaCl溶液?
B.75 mL 2 mol·L-1的氯化铵溶液?
C.150 mL 1 mol·L-1的KCl溶液?
D.75 mL 1.5 mol·L-1的氯化镁溶液?
|
对于下列离子的检验与结论正确的是 | |
| [ ] | |
A. |
加稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,原溶液一定有CO32?/P> |
B. |
加氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液一定有SO42?/P> |
C. |
加氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,原溶液一定有NH4+ |
D. |
加碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,原溶液一定有Ba2+ |
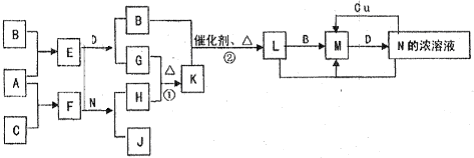


| ||
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com