
题目列表(包括答案和解析)
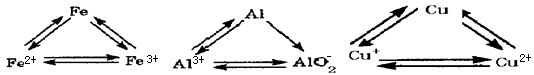
(11分)Fe、Cu都是人类最早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
(1)甲同学取两束细铜丝用砂纸打磨后在酒精灯上加热至红热,再分别伸到O2、Cl2的集气瓶中.你认为甲同学在实验中应该观察到的现象是___________________________.
(2)乙同学为验证Fe在冷的浓HNO3中发生钝化但能和热的浓HNO3反应,设计了如图所示的实验,请你指出其中的两处错误:________________________________________、______________________________________________________;纠正上述错误后,请你从绿色化学的角度出发,对装置2提出改进建议,使装置2既能控制反应的进行,又能减少氮氧化物的排放:__________________________________________.

(3)丙同学在Fe和浓HNO3反应后的溶液中加入一块Cu片,Cu片逐渐溶解,反应一段时间后不再溶解.
①丙同学依据反应现象得出Cu片溶解的原因是和HNO3发生反应.他依据的反应现象是________________________________.
②丁同学认为丙同学的结论不完全正确.他的理由是_________________________.
(4)请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+.说明具体的操作和实验现象__________________________________________.
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |

由乙烯和其他无机原料可合成环状化合物,其合成过程如下图所示(水及其他无机产物均已省略):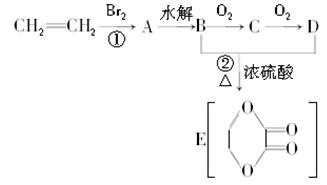
请分析后回答下列问题:
(1)反应的类型分别是①________,②________;
(2)D物质中的官能团为________;
(3)C物质的结构简式为________,物质X与A互为同分异构体,则X的结构简式为________,X的名称为________;
(4)B、D在一定条件下除能生成环状化合物E外,还可反应生成一种高分子化合物,试写出B、D反应生成该高分子化合物的方程式_______________.




湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com